Bolo obligatorio automatizado versus infusión basal para el mantenimiento de la analgesia epidural durante el trabajo de parto
Resumen
Antecedentes
El parto puede causar el dolor más intenso que algunas mujeres presentan en su vida. La analgesia epidural es una forma efectiva de alivio del dolor durante el trabajo de parto y se considera el estándar de referencia. Tradicionalmente la analgesia epidural se ha administrado como una infusión continua a través de un catéter en el espacio epidural, con o sin la posibilidad de que la paciente complemente la analgesia recibida al activar una bomba programable para aplicar dosis adicionales de recarga, conocida como analgesia epidural controlada por la paciente (AECP). Ha habido interés en la administración de medicación analgésica de mantenimiento a través de una dosis en bolo (bolo obligatorio automatizado [BOA]) en lugar de la infusión basal (IB) continua tradicional; ensayos controlados aleatorios (ECA) recientes han indicado que la técnica de BOA da lugar a una mejor analgesia y satisfacción materna.
Objetivos
Evaluar los efectos del bolo obligatorio automatizado versus la infusión basal para el mantenimiento de la analgesia epidural durante el trabajo de parto.
Métodos de búsqueda
Se hicieron búsquedas en CENTRAL, MEDLINE, Embase, en la World Health Organization International Clinial Trials Registry Platform (WHO‐ICTRP) y en ClinicalTrials.gov el 16 enero 2018. Se revisaron las listas de referencias de todos los ensayos y revisiones elegibles. También se estableció contacto con los autores de los estudios incluidos en este campo para identificar los estudios de investigación no publicados y los ensayos que aún están en marcha y se examinaron las listas de referencias de los artículos incluidos en busca de artículos potencialmente relevantes.
Criterios de selección
Se incluyeron todos los ECA que compararon la administración de BOA por dosis en bolo con la IB continua para proporcionar alivio del dolor durante la analgesia epidural para el trabajo de parto en las mujeres.
Obtención y análisis de los datos
Se utilizaron los procedimientos metodológicos estándar previstos por la Colaboración Cochrane. Los resultados primarios fueron: riesgo de dolor episódico con necesidad de intervención anestésica; riesgo de parto por cesárea; riesgo de parto instrumental. Los resultados secundarios incluyeron: duración del trabajo de parto; consumo de anestesia local. Se utilizó GRADE para evaluar la calidad de la evidencia de cada resultado.
Resultados principales
Se incluyeron 12 estudios con un total de 1121 mujeres. Diez estudios solo reclutaron pacientes nulíparas sanas y dos estudios reclutaron también pacientes que ya habían tenido un parto. Todos los estudios excluyeron a las pacientes con embarazos complicados. Hubo variaciones en la técnica de inicio de la analgesia epidural. Siete estudios utilizaron la técnica combinada epidural espinal (CEE), y los otros cinco estudios solo colocaron un catéter epidural sin inyección intratecal. Siete estudios administraron ropivacaína: seis con fentanilo y uno con sufentanilo. Dos estudios administraron levobupivacaína: uno con sufentanilo y uno con fentanilo. Tres administraron bupivacaína con o sin fentanilo. El riesgo de sesgo general de los estudios fue bajo.
El BOA probablemente reduce el riesgo de dolor episódico en comparación con la IB para mantener la analgesia epidural durante el trabajo de parto (del 33% al 20%; cociente de riesgos [CR] 0,60; intervalo de confianza [IC] del 95%: 0,39 a 0,92; diez estudios, 797 pacientes, evidencia de certeza moderada). El BOA puede lograr poco o ningún cambio en el riesgo de parto por cesárea en comparación con la IB (15% y 16% respectivamente; CR: 0,92; IC del 95%: 0,70 a 1,21; 11 estudios, 1079 pacientes, evidencia de certeza baja).
El BOA puede dar lugar a poca o ninguna diferencia en el riesgo de parto instrumental en comparación con la IB (12% y 9% respectivamente; CR: 0,75; IC del 95%: 0,54 a 1,06; 11 estudios, 1079 pacientes, evidencia de certeza baja). Probablemente hay poca o ninguna diferencia en la duración media del trabajo de parto con el BOA en comparación con la IB (diferencia de medias [DM] ‐10,38 min; IC del 95% ‐26,73 a 5,96; 11 estudios, 1079 pacientes, evidencia de certeza moderada). Probablemente hay una reducción del consumo de anestésico por hora de anestésico local con el BOA en comparación con la IB para mantener la analgesia epidural durante el trabajo de parto (DM ‐1,08 mg/h; IC del 95% ‐1,78 a ‐0,38; 12 estudios, 1121 pacientes, evidencia de certeza moderada). Cinco de siete estudios informaron un aumento de la satisfacción materna con el BOA en comparación con la IB para mantener la analgesia epidural durante el trabajo de parto; sin embargo, estos datos no se agruparon debido a su naturaleza ordinal. Siete estudios informaron las puntuaciones de Apgar, aunque hubo heterogeneidad significativa en los informes. Ninguno de los estudios mostró alguna diferencia significativa entre las puntuaciones de Apgar entre los grupos.
Conclusiones de los autores
Hay evidencia de certeza predominantemente moderada de que el BOA es similar a la IB para mantener la analgesia epidural durante el trabajo de parto para todos los resultados medidos y puede tener el efecto beneficioso de disminuir el riesgo de dolor episódico y mejorar la satisfacción materna, a la vez que disminuye la cantidad de anestésico local necesario.
PICOs
Resumen en términos sencillos
Epidural con administración intermitente (bolo obligatorio automatizado) versus constante (infusión basal) para mantener el alivio del dolor en el parto
Antecedentes
La analgesia epidural incluye la inyección de medicación para el alivio del dolor en el espacio epidural (área inmediatamente por fuera de la columna vertebral). Es una forma efectiva de analgesia durante el parto. La medicación por lo general se administra a través de una bomba programable que inyecta la medicación a través de un tubo pequeño colocado en el espacio epidural. Tradicionalmente la medicación se ha administrado a una tasa constante conocida como "infusión basal". Recientemente ha habido interés en, por el contrario, aplicar la medicación como una dosis intermitente (cada ahora y nuevamente). Esta denominada "dosis en bolo", o "bolo obligatorio automatizado", puede ser mejor para el alivio del dolor. Este estudio examinó la evidencia con respecto a dos intervenciones para el mantenimiento de la analgesia epidural en el parto: el bolo obligatorio automatizado y la infusión basal.
Características de los estudios
La evidencia está actualizada hasta enero de 2018. Se encontraron 12 estudios que incluyeron 1121 pacientes con embarazos sin complicaciones. No se evaluó específicamente la repercusión de las fuentes de financiamiento en los estudios. Las pacientes que participaron en los ensayos examinados (conocidos como ensayos controlados aleatorios) se asignaron al azar a un grupo que recibió el tratamiento investigado o a un grupo que recibió el tratamiento estándar como control. Lo anterior permite reducir cualquier sesgo que puedan provocar los investigadores o las participantes del ensayo.
Resultados clave
Se encontró que el bolo obligatorio automatizado reduce el riesgo de dolor episódico (dolor que requiere intervención médica de un anestesiólogo) en comparación con la infusión basal durante el parto. Lo anterior se logra sin aumentar el riesgo de cesárea; el riesgo de parto instrumental (si el obstetra interviene para ayudar al parto mediante fórceps obstétricos o ventosa); ni la duración del parto. También puede reducir la dosis de medicación requerida por hora. Además, cinco de siete estudios encontraron que las madres prefirieron el bolo obligatorio automatizado a la infusión basal.
Certeza de la evidencia
La evidencia fue de certeza moderada para todos los resultados medidos, con la excepción del riesgo de parto por cesárea y el riesgo de parto instrumental, que solo tuvieron certeza baja.
Conclusiones de los autores
Summary of findings
| Automated mandatory bolus versus basal infusion for maintenance of epidural analgesia in labour | |||||
| Patient or population: maintenance of epidural analgesia in labour | |||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | |
| Risk with basal infusion | Risk with automated mandatory bolus | ||||
| Breakthrough pain | Study population | RR 0.60 | 797 | ⊕⊕⊕⊝ | |
| 333 per 1000 | 200 per 1000 | ||||
| Caesarean delivery | Study population | RR 0.92 | 1079 | ⊕⊕⊝⊝ | |
| 160 per 1000 | 147 per 1000 | ||||
| Instrumental delivery | Study population | RR 0.75 | 1079 | ⊕⊕⊝⊝ | |
| 123 per 1000 | 92 per 1000 | ||||
| Duration of labour in min | The mean duration of labour in min ranged from 186.3 to 690.0 min | MD 10.38 min lower | — | 1079 | ⊕⊕⊕⊝ |
| LA consumption per hour | The mean LA consumption per hour ranged from 3 mg to 21.4 mg | MD 1.08 mg/h lower | — | 1121 | ⊕⊕⊕⊝ |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence | |||||
| aDowngraded one level due to considerable statistical heterogeneity for this outcome, i.e. I2 = 69%. | |||||
Antecedentes
Descripción de la afección
El trabajo de parto es posiblemente una de las experiencias más dolorosas que una mujer puede presentar en su vida. El dolor durante el trabajo de parto está afectado por las influencias psicosociales, las experiencias de dolor y las intervenciones obstétricas como el aumento gradual de la oxitocina. La analgesia epidural se considera el estándar de referencia para la analgesia durante el trabajo de parto y a menudo se la prefiere a otras formas de analgesia como los opiáceos sistémicos, el óxido nitroso y los métodos no farmacológicos. Es una técnica anestésica frecuente mediante la cual las pacientes reciben inyecciones de anestésicos u opiáceos locales en el espacio epidural que causan adormecimiento y debilidad en la parte inferior del cuerpo, y proporcionan alivio del dolor durante el trabajo de parto. Las pacientes reciben con mayor frecuencia anestésicos locales de acción prolongada como bupivacaína y ropivacaína. Los opiáceos como el fentanilo y el sufentanilo se coadministran de manera sistemática para complementar los efectos de los anestésicos locales.
Descripción de la intervención
Se utilizan dos técnicas para mantener la analgesia epidural durante el trabajo de parto: los bolos obligatorios automatizados y la infusión basal. El bolo inicial se administra como una dosis epidural o espinal epidural combinada. El bolo obligatorio automatizado es una técnica de administración de fármacos en el que la dosis se administra de manera intermitente en un bolo. La infusión basal es una técnica de administración de fármacos en el que la dosis se aplica de manera continua. La administración de fármacos mediante bolo obligatorio automatizado da lugar a una mayor presión de inyección (presión al inyectar la medicación) en comparación con la infusión basal; se considera que la diferencia en la técnica de administración afecta la propagación y distribución del fármaco en el espacio epidural después de la administración. Una mayor diseminación y distribución en el espacio epidural pueden proporcionar un alivio del dolor efectivo y asociarse a un riesgo menor de bloqueo motor.
La analgesia epidural controlada por la paciente (AECP) se ha establecido como una forma preferida de administración de los fármacos epidurales desde su introducción por Gambling en 1988 (Gambling 1988). La técnica de AECP permite la activación iniciada por la paciente de un bolo de la medicación analgésica para controlar el dolor durante el trabajo de parto. En comparación con la infusión epidural continua, los estudios han mostrado que la AECP reduce el dolor episódico que requiere intervención anestésica, reduce el consumo de anestésico local sin comprometer la eficacia analgésica y aumenta la satisfacción de las pacientes al permitir su autonomía durante el trabajo de parto. La AECP se administra habitualmente con una infusión basal además de los bolos, a petición de las pacientes.
De qué manera podría funcionar la intervención
Los modelos en cadáveres y experimentales han indicado que los fármacos epidurales administrados como bolos pueden dar lugar a una diseminación mayor y más uniforme de los fármacos en el espacio epidural (Hogan 2002; Kaynar 1999). Hogan encontró que la diseminación de los líquidos en el espacio epidural es muy poco uniforme a través de múltiples canales pequeños e indicó que la diseminación sería más uniforme al utilizar volúmenes grandes y una presión de inyección correspondientemente alta cerca del sitio de inyección para involucrar la mayor cantidad de canales (Hogan 2002). El modelo experimental de Kaynar y Shankar utilizó un catéter epidural con múltiples orificios con la administración de bolos o infusión continua (Kaynar 1999). La técnica del bolo dio lugar a una diseminación mayor y más uniforme del agente de contraste, aunque la infusión continua dio lugar a una menor diseminación a través del puerto proximal del catéter epidural.
Varios ensayos han indicado que la técnica del bolo obligatorio automatizado parece aliviar el dolor episódico y aumentar la satisfacción de las pacientes durante la analgesia epidural en el trabajo de parto, debido a una diseminación más uniforme en el espacio epidural (Fettes 2006; Lim 2005; Sia 2013; Wong 2006). Las dos formas de administración de los fármacos epidurales difieren en la presión de inyección generada durante la administración de los fármacos, aunque la cantidad total del fármaco puede ser similar (p.ej. cantidad de fármaco en una hora).
Por qué es importante realizar esta revisión
En el desarrollo de la analgesia epidural, varios ensayos han comparado el mantenimiento de la analgesia epidural mediante bolos obligatorios automatizados con la infusión basal, pero ninguno ha mostrado de manera concluyente que una técnica sea superior a la otra (Capogna 2011; Chua 2004; Ferrer 2017; Fettes 2006; Leo 2010; Lim 2005; Lim 2010; Lin 2016; Salim 2005; Sia 2007; Sia 2013; Wong 2006). Chua y Sia realizaron el primer ensayo clínico que indicó que la técnica del bolo aumentó la duración y la calidad de la analgesia durante la analgesia epidural en 42 pacientes nulíparas en trabajo de parto (Chua 2004). Varios estudios han encontrado que los bolos obligatorios automatizados pueden aliviar el dolor episódico (presencia de dolor a pesar de tener una medicación epidural que requiere que un anestesista proporcione medicación analgésica adicional) en comparación con la infusión continua (Ferrer 2017; Fettes 2006; Lim 2005; Sia 2013; Wong 2006), aunque otros no han observado diferencias entre las dos técnicas (Capogna 2011; Leo 2010; Lim 2010; Salim 2005; Sia 2007). También existe la posibilidad de que el bolo obligatorio automatizado pueda reducir el riesgo o el grado de bloqueo motor, lo que puede dar lugar a una disminución del parto vaginal instrumental y a una mayor satisfacción materna (Capogna 2011).
En la actualidad no existe evidencia clara de si esta nueva tecnología de administración de los anestésicos es superior a la práctica actual. Se consideraron los resultados anestésicos, obstétricos y fetales relevantes para las pacientes y los efectos secundarios de los tratamientos, que incluyen el riesgo de dolor episódico, el parto por cesárea, el parto instrumental, el consumo de anestésico local y la duración del trabajo de parto. Si se encuentra que una intervención es más efectiva o más segura, o que da lugar a una disminución en los fármacos totales utilizados, la práctica de la administración de fármacos epidurales se podría estandarizar más para la analgesia epidural durante el trabajo de parto.
Objetivos
Evaluar los efectos del bolo obligatorio automatizado versus la infusión basal para el mantenimiento de la analgesia epidural durante el trabajo de parto.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron los ensayos controlados aleatorios (ECA) de grupos paralelos que compararon la administración de bolo obligatorio automatizado con la infusión basal para proporcionar alivio del dolor mediante la analgesia epidural durante el trabajo de parto. Los estudios se incluyeron independientemente del idioma y la fecha y el tipo de publicación. Se incluyeron estudios con y sin un componente de analgesia epidural controlada por la paciente (AECP).
Se excluyeron los estudios no aleatorios como los estudios de cohortes debido a su mayor riesgo de sesgo. También se excluyeron los ensayos cruzados, ya que esta metodología no es apropiada para evaluar las intervenciones que se administran en un punto temporal específico. Se excluyeron los estudios con bolos obligatorios automatizados e infusión basal combinados. También se excluyeron los estudios que no utilizaron la administración automatizada de dosis en bolo.
Tipos de participantes
Se incluyeron los estudios que reclutaron embarazadas a término que solicitaron analgesia epidural durante el trabajo de parto.
Se excluyeron los estudios que reclutaron pacientes en trabajo de parto prematuro, con embarazo múltiple o con malposición fetal, incluidas las presentaciones podálicas.
Tipos de intervenciones
Se incluyeron los estudios que compararon la administración de bolos obligatorios automatizados intermitentes con la infusión basal para el mantenimiento de la analgesia epidural en el trabajo de parto. Se incluyeron todos los anestésicos locales, con o sin regímenes de mantenimiento con opiáceos, administrados durante la analgesia epidural.
Se excluyeron las parturientas (embarazadas en trabajo de parto) que recibieron un catéter intratecal o espinal para el alivio del dolor durante el trabajo de parto. Se excluyeron los estudios que utilizaron bolos aplicados manualmente.
Tipos de medida de resultado
Resultados primarios
-
Riesgo de dolor episódico con necesidad de intervención anestésica (dicotómico)
-
Riesgo de parto por cesárea (dicotómico) (resultado de seguridad)
-
Riesgo de parto instrumental (dicotómico) (resultado de seguridad)
Resultados secundarios
-
Duración de la analgesia durante el trabajo de parto (continuo)
-
Consumo de anestésico local por hora (continuo)
-
Satisfacción materna (escala ordinal corta)
-
Puntuaciones de Apgar (continuo): medidas con la escala de puntuaciones de Apgar (resultado de seguridad)
Se consideró que la diferencia mínimamente importante para el riesgo de dolor episódico, el riesgo de parto por cesárea y el riesgo de parto instrumental al comparar el bolo obligatorio automatizado con la infusión basal fue del 5% para cada resultado.
Métodos de búsqueda para la identificación de los estudios
Búsquedas electrónicas
We searched the Cochrane Central Register of Controlled Trials (CENTRAL; 2018, Issue 1); MEDLINE (January 1966 to 16 January 2018) and Embase (January 1980 to 16 January 2018). We also searched the World Health Organization International Clinial Trials Registry Platform (WHO‐ICTRP) (August 2005 to 16 January 2018), and clinicaltrials.gov (February 2000 to 16 January 2018). Appendix 1 describes our search strategies for CENTRAL, MEDLINE, Embase, WHO‐ICTRP and clinicaltrials.gov.
We searched the Cochrane Pregnancy and Childbirth Group Trials Register with the Highly Sensitive Search Strategy (HSSS) found in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011), with the help of their Trials Search Co‐ordinator. In addition, we screened the bibliography of included studies to identify potentially eligible records. We did not place any language restrictions on our searches.
Búsqueda de otros recursos
We used free‐text terms in all databases and subject headings in combination when thesauri were a component of a database.
We reviewed the 'Related articles' feature of PubMed for all eligible trials and reviews.
We screened the reference lists of all eligible trials and reviews.
We also contacted authors of included studies in this field in order to identify unpublished research and trials still underway on 8 July 2016. We screened the reference lists of the included articles for potentially relevant articles.
Obtención y análisis de los datos
Two authors (LWL, OTT) independently collected data on a standardized data collection form (see Appendix 2), and a third author (SBL) resolved any remaining disagreements through discussion.
Selección de los estudios
Two authors (LWL, OTT) independently assessed for inclusion all the potential studies we identified as a result of the search strategy (Criteria for considering studies for this review) and reviewed the titles and abstracts from the searches.
Extracción y manejo de los datos
Two authors (LWL, OTT) independently extracted the data using a standardized form (see Appendix 2). We extracted information pertaining to the study design, method of randomization, use of allocation concealment, reporting of the study setting and participants, inclusion and exclusion criteria, sample size, interventions and outcomes. Two authors (SBL, FJS) entered and checked the data independently, and a third author (PNA) resolved disagreements.
Evaluación del riesgo de sesgo de los estudios incluidos
Two authors (LWL, OTT) independently assessed trial quality and risk of bias for each study using the criteria outlined in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011), and a third author (SBL) resolved any disagreements.
Based on the Cochrane 'Risk of bias' tool in Review Manager 5 (RevMan 5) (RevMan 2014), we considered the following domains (Higgins 2011): random sequence generation, allocation concealment, blinding of participants and personnel, blinding of outcome assessment, incomplete outcome data, selective reporting, and other bias. Appendix 3 presents the details on the Cochrane 'Risk of bias' tool and criteria for judgment.
We graded each of the above dimensions of trial quality as being at low, high or unclear risk of bias. Given the low risk of bias for all studies and high quality of evidence for each outcome, we did not conduct a stratified analysis based on study quality.
Medidas del efecto del tratamiento
Dichotomous data
For dichotomous data, we presented results as summary risk ratio (RR) with 95% confidence intervals (CIs).
Continuous data
For continuous data, we used the mean difference (MD) if trials measured the outcomes in the same way. We planned to use the standardized mean difference (SMD) to obtain pooled estimates of an outcome measured on different scales.
Cuestiones relativas a la unidad de análisis
The woman was the unit of analysis in all of the studies.
Manejo de los datos faltantes
We attempted to contact the study authors if key information was unavailable in the publications.
Evaluación de la heterogeneidad
We evaluated clinical heterogeneity by qualitatively appraising differences in study characteristics such as participants, interventions, outcomes assessed and study methodology. Quantitative pooling of the data was first justified by a consensus clinical judgement of sufficient clinical homogeneity. We informally evaluated and investigated the degree of statistical heterogeneity by visual inspection of forest plots and more formally by using the Tau2, I2 and Chi2 statistics. We regarded heterogeneity as considerable if I2 was greater than 75%, substantial if I2 was between 50% and 90%, moderate if I2 was between 30% and 60%, and low if I2 was less than 40%.
Evaluación de los sesgos de notificación
We checked the methodology and study protocols of the primary studies where available. We assessed publication bias and other small study effects in a qualitative manner using a funnel plot.
In future updates of this review, we will test for funnel plot asymmetry using weighted linear regression of effect estimates on their standard error if more than 10 trials are included (Egger 1997).
Síntesis de los datos
We carried out statistical analyses using RevMan 2014. For data synthesis of dichotomous outcomes, we used the Mantel‐Haenszel method and reported the RRs and 95% CIs. For continuous outcomes we used the inverse variance method. We analysed maternal satisfaction as a continuous outcome, even if measured on ordinal scales. Some studies administered ropivacaine or levobupivacaine local anaesthesia in place of bupivacaine. For such studies we assumed 60% potency of bupivacaine based on a similar systematic review and meta‐analysis (George 2012). Hence we multiplied the means and standard deviations by 0.6. We used the RR to report pooled results for dichotomous outcomes. We used MDs to pool the results of the continuous outcomes. Where studies reported medians and interquartile ranges, we obtained the means and standard deviations (SD) from George 2012, we converted them using the formula by Hozo 2005, or we excluded them from the meta‐analysis and reported results qualitatively.
We expected both clinical and statistical heterogeneity, and therefore we used the random‐effects model to meta‐analyse all outcomes.
Análisis de subgrupos e investigación de la heterogeneidad
We performed the following subgroup analysis for all the outcomes.
-
Local anaesthetic alone versus local anaesthetic plus opioid regimens.
-
Epidural technique: epidural alone versus combined spinal‐epidural technique.
-
PCEA: regimens that used PCEA versus those that did not.
Análisis de sensibilidad
We did not perform sensitivity analyses because the quality of the studies was consistent across the different studies (Risk of bias in included studies).
We will consider performing sensitivity analysis in future updates of this review if required.
Sensitivity analysis for trial quality involves analysis based on rating of selection bias and attrition bias. We would exclude studies of poor quality from the analysis (those rated as unclear or high risk of bias) in order to assess for any substantive difference to the overall result. The sensitivity analysis for compliance would be based on trials where women did not receive their allocated treatment, combination therapy or intervention, or they received an additional form of analgesia to the one allocated. These sensitivity analyses will use only the primary outcomes.
'Summary of findings' table
We used the principles of the GRADE system in order to assess the certainty of the body of evidence associated with the following specific outcomes (Guyatt 2008).
-
Risk of breakthrough pain requiring anaesthetic intervention.
-
Risk of caesarean delivery.
-
Risk of instrumental delivery.
-
Duration of labour analgesia.
-
Total dose of local anaesthetic per hour.
We constructed a 'Summary of findings' table comparing automated mandatory bolus versus basal infusion therapy using GRADEpro software (GRADEpro GDT 2015). The GRADE approach assesses the certainty of a body of evidence based on the extent to which one can be confident that an estimate of effect or association reflects the item being assessed. Assessment of the certainty of a body of evidence involved considering the methodological quality of studies, the directness of the evidence, the heterogeneity of the data, the precision of the effect estimates and the risk of publication bias.
Results
Description of studies
Results of the search
See Figure 1.
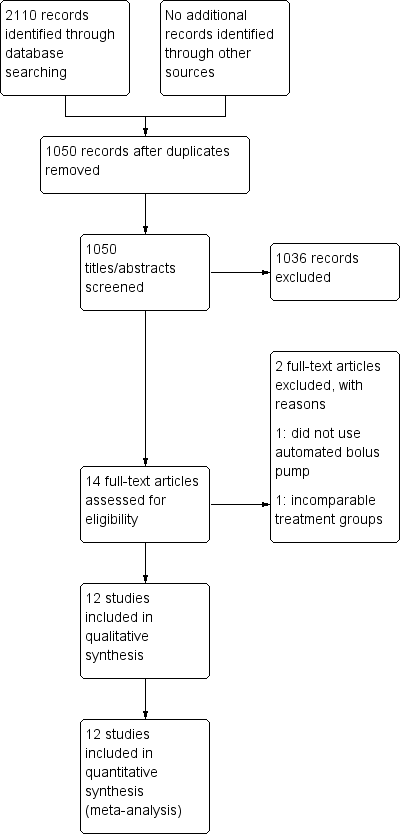
Study flow diagram.
We identified 2110 citations from the database searches. After screening by title and abstract, we obtained full text articles for 14 citations that we judged as potentially eligible for inclusion in the review. After excluding one study that did not use an automated bolus pump as their intervention and one study that utilized varying concentrations and volumes of local anaesthetic (rendering the different groups incomparable), we finally included 12 studies in our review.
Included studies
Characteristics of included studies
We included 12 studies involving 1121 women. Ten of the 12 studies enrolled healthy nulliparous women (Capogna 2011; Chua 2004; Fettes 2006; Leo 2010; Lim 2005; Lim 2010; Lin 2016; Salim 2005; Sia 2007; Sia 2013), while two studies enrolled healthy parous women at term (Ferrer 2017; Wong 2006). Ten studies involved women with singleton fetus in vertex presentation, while two studies did not specify the fetal position (Ferrer 2017; Lin 2016). All studies excluded women with complicated pregnancies.
All 12 studies reported the local anaesthetic consumption (either as total consumed or per hour consumption). The other outcomes included breakthrough pain, number of women who underwent caesarean delivery, number of women who underwent instrumental birth, duration of labour (total or first and second stage) and Apgar scores.
There were variations in the technique of initiation of epidural analgesia. Seven studies used the combined spinal epidural (CSE) technique (Chua 2004; Leo 2010; Lim 2005; Lim 2010; Sia 2007; Sia 2013; Wong 2006), with two of these studies giving only an opioid (fentanyl in both) without any local anaesthetic intrathecally (Chua 2004; Lim 2005). The other five studies only placed an epidural catheter without any intrathecal injection (Capogna 2011; Ferrer 2017; Fettes 2006; Lin 2016; Salim 2005).
There was also variation with the analgesic medications given in terms of the choice of drugs as well as the dosages. Six studies utilized ropivacaine with fentanyl (Chua 2004; Fettes 2006; Leo 2010; Lim 2010; Sia 2007; Sia 2013), one used ropivacaine with sufentanil (Lin 2016). Two studies utilized levobupivacaine: Capogna 2011 with sufentanil and Lim 2005 with fentanyl, and three studies utilized bupivacaine with or without fentanyl (Ferrer 2017; Salim 2005; Wong 2006).
In one study, the analgesic medication provided differed between the two groups, with the AMB group receiving bupivacaine only and the BI group receiving bupivacaine plus fentanyl (Salim 2005).
Excluded studies
We excluded two studies in total. One study did not use automated mandatory boluses but rather manual intermittent boluses (Patkar 2015). In the other, the interventions between the groups were not comparable: the continuous infusion group received half the volume of local anaesthetic as the AMB group, and there were two different concentrations of local anaesthetic administered to the two different AMB groups (Nunes 2014).
See Characteristics of excluded studies.
Studies awaiting classification
There are no studies awaiting classification.
Ongoing studies
We identified no ongoing studies.
Risk of bias in included studies

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
Overall, there was low risk of selection, performance, detection, attrition and reporting bias, and no overt sources of other potential biases in the included studies. For allocation bias, 6 of the 12 studies reported the methods for both randomization and allocation (computer‐generated random numbers and sealed opaque envelopes respectively). Three studies reported using a computer‐generated randomization sequence but no allocation concealment (Ferrer 2017; Lim 2005; Salim 2005), and three studies reported using sealed opaque envelopes for allocation concealment but no randomization (Chua 2004; Lim 2010; Lin 2016). For performance and detection bias, 10 studies were double‐blinded and provided a description of the blinding, while one study did not report any blinding (Salim 2005), and one study was single‐blinded (Ferrer 2017). Apart from Lim 2005, no studies specifically mentioned performing an intention‐to‐treat analysis. All studies reported prespecified outcomes and had minimal missing data (< 10%). We therefore judged them to be at low risk of attrition and reporting bias.
Allocation
Nine studies utilized computer‐generated random numbers for randomization (Capogna 2011; Ferrer 2017; Fettes 2006; Leo 2010; Lim 2010; Salim 2005; Sia 2007; Sia 2013; Wong 2006). We judged these studies to be at low risk for selection bias (random sequence generation). Three studies did not describe the method of randomization (Chua 2004; Lim 2010; Lin 2016). We judged these studies as being at unclear risk of selection bias (random sequence generation).
Nine studies utilized sealed opaque envelopes for allocation (Capogna 2011; Chua 2004; Fettes 2006; Leo 2010; Lim 2010; Lin 2016; Sia 2007; Sia 2013; Wong 2006). We judged these studies as being at low risk of selection bias (allocation concealment). Three studies did not describe the method of allocation concealment (Ferrer 2017; Lim 2005; Salim 2005). Although Ferrer 2017 and Salim 2005 did state that the allocation was concealed, we judged these studies to be at unclear risk of selection bias (allocation concealment) because the method of allocation concealment was not described.
Blinding
Ten studies were double‐blinded and provided a description of the blinding (Capogna 2011; Chua 2004; Fettes 2006; Leo 2010; Lim 2005; Lim 2010; Lin 2016; Sia 2007; Sia 2013; Wong 2006). The principal investigator performed one of these blocks in one study, but a blinded anaesthetist handled subsequent data collection (Chua 2004). We judged these studies to be at low risk of performance bias except for Chua 2004, which we judged to be at unclear risk for performance bias.
One study described itself as single‐blinded, although the research assistant and the nurse staff in charge of drug administration were the only ones that knew the randomization sequence. Neither the participant nor the attending anaesthesiologist or the outcome assessor knew the randomization sequence (Ferrer 2017), so we judged it to be at low risk. One study did not describe blinding (Salim 2005), so we judged this study to be at unclear risk of performance and detection bias.
Incomplete outcome data
All 12 studies had a low risk of attrition bias, reporting all outcome data (recruitment and attrition data) with no missing data. We performed the analyses using the intention‐to‐treat principle (Capogna 2011; Chua 2004; Ferrer 2017; Fettes 2006; Leo 2010; Lim 2005; Lim 2010; Lin 2016; Salim 2005; Sia 2007; Sia 2013; Wong 2006). We judged all studies to be at low risk of attrition bias.
Selective reporting
All 12 studies reported all prespecified outcomes, and we judged them to be at low risk for reporting bias (Capogna 2011; Chua 2004; Fettes 2006; Ferrer 2017; Leo 2010; Lim 2005; Lim 2010; Lin 2016; Salim 2005; Sia 2007; Sia 2013; Wong 2006). The funnel plot also suggested no reporting bias (Figure 4).

Funnel plot of comparison: 1 Automated mandatory bolus vs basal infusion, outcome: 1.2 Breakthrough pain (epidural vs CSE).
Other potential sources of bias
We judged all 12 studies to be at low risk for other bias (Capogna 2011; Chua 2004; Ferrer 2017; Fettes 2006; Leo 2010; Lim 2005; Lim 2010; Lin 2016; Salim 2005; Sia 2007; Sia 2013; Wong 2006).
Effects of interventions
See summary of findings Table for the main comparison.
Primary outcomes
1. Risk of breakthrough pain
Ten studies in 797 women reported the incidence of breakthrough pain (Capogna 2011; Chua 2004; Ferrer 2017; Fettes 2006; Leo 2010; Lim 2005; Lim 2010; Sia 2007; Sia 2013; Wong 2006). The pooled results showed automated mandatory bolus probably reduces the risk of breakthrough pain (RR 0.60 95%, CI −0.39 to 0.92; Analysis 1.1) compared to continuous infusion for maintaining epidural analgesia.
There was substantial heterogeneity (I2 = 69%). The overall certainty of evidence based on GRADE was moderate.
We grouped studies on the basis of the method of initiation of the epidural (epidural versus combined spinal‐epidural). For the subgroup of CSE, the automated mandatory bolus probably reduces the risk of breakthrough pain (RR 0.71, 95% CI 0.44 to 1.13, random‐effects, 7 studies, 484 participants; moderate‐certainty evidence; Analysis 1.2) compared to continuous infusion for maintenance of epidural analgesia. There was substantial heterogeneity (I2 = 64%).
2. Risk of caesarean delivery (safety outcome)
Eleven studies in 1079 women reported the incidence of caesarean delivery (Capogna 2011; Ferrer 2017; Fettes 2006; Leo 2010; Lim 2005; Lim 2010; Lin 2016; Salim 2005; Sia 2007; Sia 2013; Wong 2006). The pooled results showed that automated mandatory bolus may make little or no difference in the risk of caesarean delivery (RR 0.92, 95% CI 0.70 to 1.21, random‐effects; Analysis 1.5) compared with continuous infusion for maintenance of epidural analgesia. This difference was also not clinically meaningful as the risk difference did not exceed 5% (RD 0.00, 95% CI −0.03 to 0.03).
There was low heterogeneity (I2 = 0%). The overall certainty of the evidence based on GRADE was low.
3. Risk of instrumental delivery (safety outcome)
Eleven studies in 1079 women reported the incidence of instrumental delivery (Capogna 2011; Ferrer 2017; Fettes 2006; Leo 2010; Lim 2005; Lim 2010; Lin 2016; Salim 2005; Sia 2007; Sia 2013; Wong 2006). The pooled results showed that automated mandatory bolus may make little or no difference in the risk of instrumental delivery (RR 0.75, 95% CI 0.54 to 1.06, random‐effects; Analysis 1.10) compared with continuous infusion. The difference was also not clinically meaningful, as the risk difference did not exceed 5% difference (RD −0.03, 95% CI −0.06 to −0.01).
There was low heterogeneity (I2 = 0%). The overall certainty of the evidence based on GRADE was low .
Secondary outcomes
1. Duration of labour analgesia in minutes
Eleven studies in 1079 women reported the duration of labour analgesia (Capogna 2011; Ferrer 2017; Fettes 2006; Leo 2010; Lim 2005; Lim 2010; Lin 2016; Salim 2005; Sia 2007; Sia 2013; Wong 2006). The pooled results showed that automated mandatory bolus probably makes little or no difference in the duration of labour analgesia (MD −10.38 min, 95% CI −26.73 to 5.96, random‐effects; Analysis 1.15) compared with continuous infusion. There was low heterogeneity (I2 = 28%), and the overall certainty of the evidence based on GRADE was moderate.
We grouped studies based on the regimen used to maintain epidural analgesia (PCEA versus no PCEA). For the subgroup that utilized PCEA, the results showed that automated mandatory bolus probably reduces the duration of labour analgesia (MD −13.24 min, 95% CI −20.71 to −5.76, random‐effects; 7 studies, 801 participants; Analysis 1.18) compared with continuous infusion for maintenance of epidural analgesia. There was low heterogeneity (I2 = 0%). For the subgroup that did not utilize PCEA, the results showed that automated mandatory bolus probably makes little or no difference in the duration of labour analgesia (MD −48.65 min, 95% CI −129.92 to 32.62, random‐effects; 4 studies, 278 participants; Analysis 1.18) compared with continuous infusion. There was substantial heterogeneity (I2 = 73%).
2. Local anaesthetic consumption per hour
Twelve studies in 1121 women reported the local anaesthetic consumption per hour (Capogna 2011; Chua 2004; Ferrer 2017; Fettes 2006; Leo 2010; Lim 2005; Lim 2010; Lin 2016; Salim 2005; Sia 2007; Sia 2013; Wong 2006). We accounted for differing LAs used by various studies by converting them to bupivacaine equivalents as described in a previous study (George 2012). The pooled results showed that automated mandatory bolus probably reduces local anaesthetic consumption per hour in parturients admitted into the labour ward (MD −1.08 mg/h, 95% CI −1.78, −0.38; random‐effects; Analysis 1.20) compared to continuous infusion for maintenance of epidural analgesia. There was considerable heterogeneity (I2 = 89%). The overall certainty of the evidence based on GRADE was moderate.
We grouped studies based on the regimen used to maintain epidural analgesia (PCEA versus no PCEA). For the subgroup that utilized PCEA, the results showed that automated mandatory bolus probably reduces local anaesthetic consumption per hour in parturients admitted into the labour ward (MD −1.59 mg/h, 95% CI −2.58 to −0.60, random‐effects; 7 studies, 801 participants; Analysis 1.23) as compared to continuous infusion. There was considerable heterogeneity (I2 = 81%). For the subgroup that did not utilize PCEA, the results showed that automated mandatory bolus may make little or no difference in the amount of local anaesthetic consumed per hour (MD −0.53 mg/h, 95% CI −1.58, 0.52, random‐effects; 4 studies, 278 participants; Analysis 1.23) as compared with continuous infusion for maintenance of epidural analgesia. There was high heterogeneity (I2 = 92%).
3. Maternal satisfaction
Seven studies in 570 women reported maternal satisfaction scores (Ferrer 2017; Leo 2010; Lim 2005; Lim 2010; Sia 2007; Sia 2013; Wong 2006). The common definition of maternal satisfaction is using a score of 0 (very dissatisfied) to 100 (very satisfied) using patient verbal reporting or a visual analogue scale (VAS) for pain as a proxy for satisfaction. As maternal satisfaction scores are ordinal in nature, we have decided to review the data qualitatively. Five studies reported increased maternal satisfaction with AMB as compared to BI (Leo 2010; Lim 2005; Lim 2010; Sia 2013; Wong 2006), while two studies found no difference in maternal satisfaction between AMB and BI (Ferrer 2017; Sia 2007).
4. Apgar scores: measured by Apgar score scale (safety outcome)
Nine studies reported Apgar scores, with one study reporting Apgar scores at 1, 5 and 10 minutes (Ferrer 2017), four studies reporting Apgar scores at 5 minutes (Leo 2010; Lim 2005; Lim 2010; Sia 2013), three studies reporting Apgar scores at both 1 and 5 minutes (Fettes 2006; Lin 2016; Salim 2005), and one study reporting Apgar scores greater than seven at 5 minutes (Sia 2007). In view of heterogeneity of reporting we have decided to review the data qualitatively. None of the studies showed any significant difference between Apgar scores between groups.
Discusión
Resumen de los resultados principales
Evidencia de certeza moderada de 12 estudios (1121 pacientes) que contribuyeron con datos a los resultados de esta revisión mostraron una reducción significativa en el riesgo de dolor episódico con el bolo obligatorio automatizado (BOA) en comparación con la infusión basal (IB). Hubo evidencia de certeza alta que no mostró diferencias en el riesgo de parto por cesárea entre los grupos, aunque evidencia de certeza moderada no mostró diferencias en el riesgo de parto instrumental. Hubo evidencia de certeza moderada que no mostró diferencias en la duración de la analgesia durante el trabajo de parto. Es de señalar que cuatro estudios informaron la duración desde el inicio de la analgesia epidural hasta el momento del dolor episódico (Lim 2005; Leo 2010; Lim 2010; Sia 2013), pero no hubo diferencias entre los grupos. Pocas participantes en cada estudio tuvieron dolor episódico, lo que dio lugar a un número pequeño de eventos. Hubo evidencia de certeza moderada de una reducción estadísticamente significativa del consumo de anestésico local por hora con el BOA. De manera cualitativa hubo una mayor satisfacción materna con el BOA en comparación con la IB y ninguna diferencia en las puntuaciones de Apgar entre el BOA y la IB.
Los 12 estudios identificaron y analizaron la mayoría de los objetivos de la revisión. Sin embargo, solo siete de los 12 estudios informaron la satisfacción materna. Los resultados de esta revisión son relevantes para la práctica actual porque los BOA se utilizan cada vez más en el mundo.
Compleción y aplicabilidad general de las pruebas
Diez de los 12 estudios incluidos reclutaron pacientes nulíparas sanas (Capogna 2011; Chua 2004; Fettes 2006; Leo 2010; Lim 2005; Lim 2010; Lin 2016; Salim 2005; Sia 2007; Sia 2013), mientras que un estudio reclutó pacientes a término que ya habían tenido un parto (Wong 2006) y un estudio reclutó pacientes nulíparas y multíparas (Ferrer 2017). Diez estudios incluyeron pacientes con un feto único en presentación de vértice, mientras que dos estudios no especificaron la posición fetal (Ferrer 2017; Lin 2016); los 12 estudios excluyeron a las pacientes con embarazos complicados. Los estudios tuvieron el alcance suficiente para abordar los objetivos de la revisión e investigaron a las participantes, las intervenciones y los resultados más relevantes; sin embargo, solo dos estudios incluyeron pacientes multíparas.
Calidad de la evidencia
Los 12 estudios con 1121 pacientes informaron la asignación aleatoria, pero solo nueve describieron el método de asignación al azar, y todos utilizaron números aleatorios generados por computadora (Capogna 2011; Ferrer 2017; Fettes 2006; Leo 2010; Lim 2005; Salim 2005; Sia 2007; Sia 2013; Wong 2006). Nueve estudios informaron el método de ocultación de la asignación, que consistió en sobres cerrados oscuros en todos los casos (Capogna 2011; Chua 2004; Fettes 2006; Leo 2010; Lim 2010; Lin 2016; Sia 2007; Sia 2013; Wong 2006). Hubo un riesgo de selección general bajo.
En general hubo riesgo bajo de sesgo de realización, sesgo de detección, sesgo de desgaste, sesgo de informe y otro posible sesgo. La certeza general de la evidencia fue moderada para la incidencia de dolor episódico, el parto instrumental, la duración del trabajo de parto y el consumo de anestesia local por hora. Lo anterior se debió principalmente a la imprecisión, como resultado de los intervalos de confianza del 95% amplios. La calidad de la evidencia para el riesgo de parto por cesárea fue alta.
Sesgos potenciales en el proceso de revisión
En el proceso de revisión pueden surgir sesgos potenciales a partir de la heterogeneidad clínica debido a los siguientes factores: los diferentes tipos y concentraciones de anestesia local (detalles proporcionados en Síntesis de los datos), la administración de coadyuvantes (p.ej. opiáceos), la técnica de inicio de la analgesia epidural (epidural sola versus espinal‐epidural combinadas) y los métodos para informar las puntuaciones de Apgar. Las pacientes podrían recibir analgesia epidural en diversas etapas del trabajo de parto y tendrían diferentes umbrales de dolor. Por lo tanto, el inicio diferente de la analgesia epidural podría influir en la duración de su uso, el consumo de anestésico local y la probabilidad de desarrollar bloqueo motor. El aumento gradual de la administración de oxitocina también se debe considerar un factor de confusión.
El posible sesgo también puede surgir de la heterogeneidad estadística, incluso después de la estratificación en subgrupos preplanificados. Sin embargo, no se seleccionaron subgrupos según la heterogeneidad estadística prevista, sino después de considerar cuidadosamente las subpoblaciones clínicamente significativas que pueden ser generalizables a otras poblaciones similares.
Con respecto a la búsqueda, puede surgir un posible sesgo de publicación debido a los diferentes términos de búsqueda utilizados para cada base de datos y al hecho de que no fue posible identificar estudios no publicados a través de los contactos con los autores. Al considerar lo anterior, se desarrolló una estrategia de búsqueda muy sensible y la búsqueda se extendió más allá de CENTRAL, Embase y Pubmed para incluir registros de ensayos (clinicaltrials.gov y www.who.int/ictrp/en) y una base de datos específica de la disciplina (Registro de Ensayos de Grupo Cochrane de Embarazo y Parto).
Alex Sia es el autor de seis de los estudios incluidos en esta revisión (Chua 2004; Leo 2010; Lim 2005; Lim 2010; Sia 2007; Sia 2013). No participó en el proceso de evaluación de la calidad de los artículos ni en el resumen de los datos de los artículos.
Acuerdos y desacuerdos con otros estudios o revisiones
Se comparó esta revisión con la revisión sistemática realizada por George 2012. Los datos de la presente revisión son consistentes con los de esta, y se utilizó el mismo método de conversión para los estudios con diferentes anestésicos locales a equivalentes de bupivacaína. También se incluyeron dos estudios adicionales en esta revisión (Lin 2016; Sia 2013).
Los presentes resultados muestran una coincidencia adecuada con la revisión de George y colegas en cuanto a los resultados agrupados (George 2012). Se encontraron resultados similares en el riesgo de parto por cesárea (ninguna diferencia), parto instrumental (ninguna diferencia), consumo de anestésico local (disminuyó con el BOA) y satisfacción materna (aumentó con el BOA). También se encontró una disminución en la duración del trabajo de parto con el BOA, mientras que George 2012 encontró una disminución en la duración de la segunda etapa del trabajo de parto con el BOA (en esta revisión no se analizó por separado la duración de la primera y la segunda etapa del trabajo de parto). Sin embargo, en la presente revisión se encontró una disminución en el riesgo de dolor episódico con el BOA, mientras que George 2012 no la encontró.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Funnel plot of comparison: 1 Automated mandatory bolus vs basal infusion, outcome: 1.2 Breakthrough pain (epidural vs CSE).

Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 1 Breakthrough pain.

Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 2 Breakthrough pain (epidural vs CSE).

Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 3 Breakthrough pain (PCEA vs no PCEA).

Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 4 Breakthrough pain (nulliparous vs multiparous).

Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 5 Caesarean delivery.

Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 6 Caesarean delivery (LA + opioids vs LA alone).
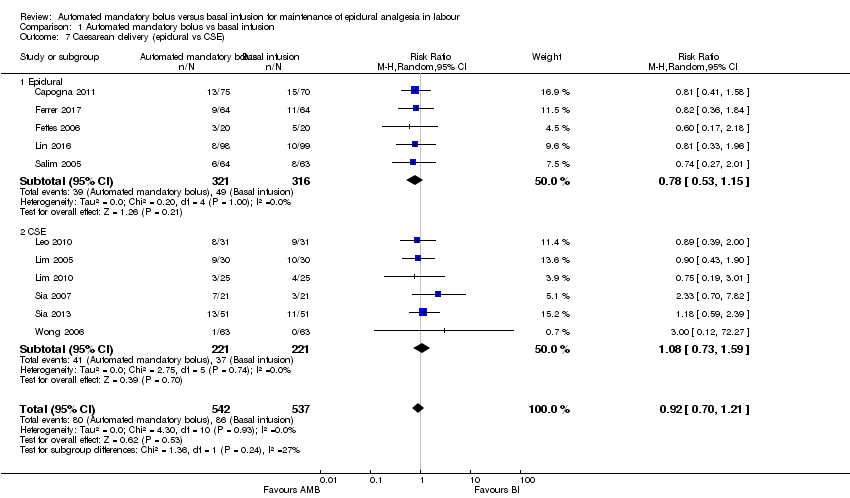
Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 7 Caesarean delivery (epidural vs CSE).
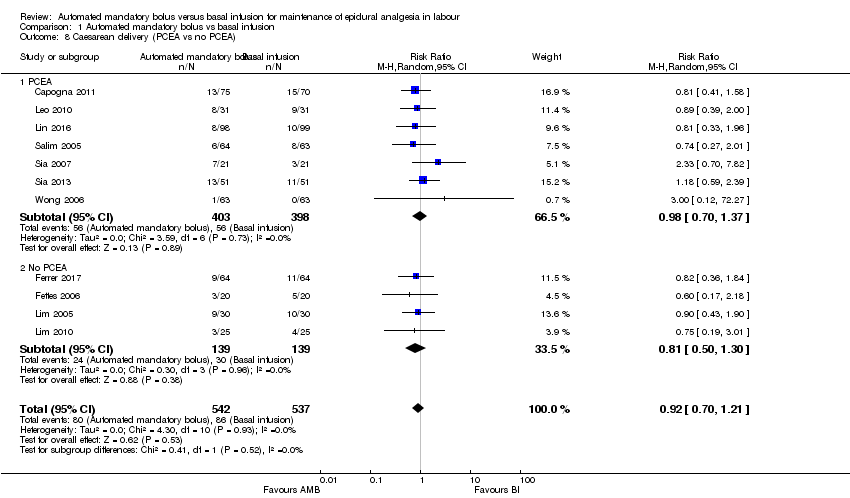
Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 8 Caesarean delivery (PCEA vs no PCEA).
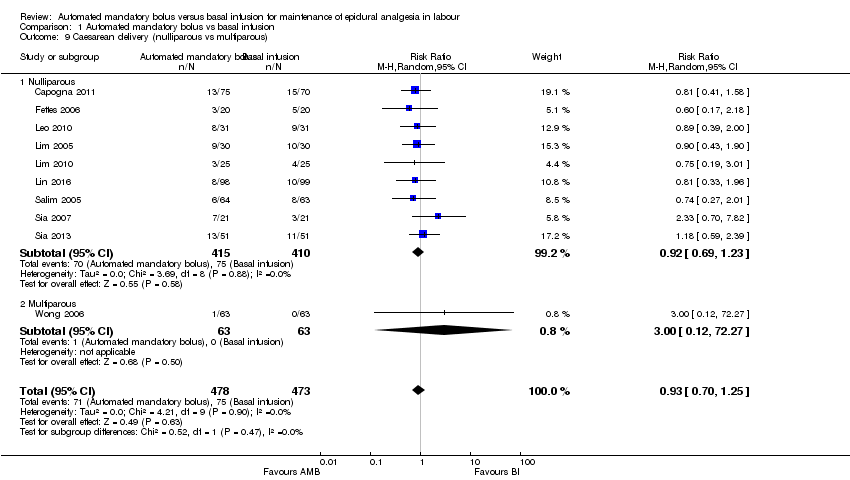
Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 9 Caesarean delivery (nulliparous vs multiparous).
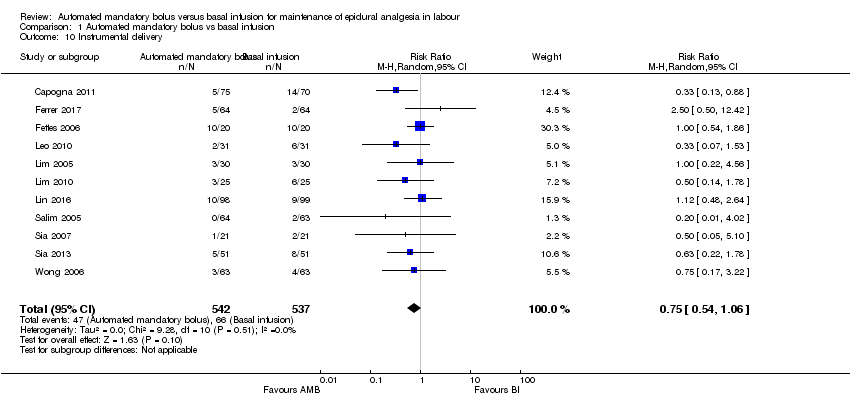
Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 10 Instrumental delivery.
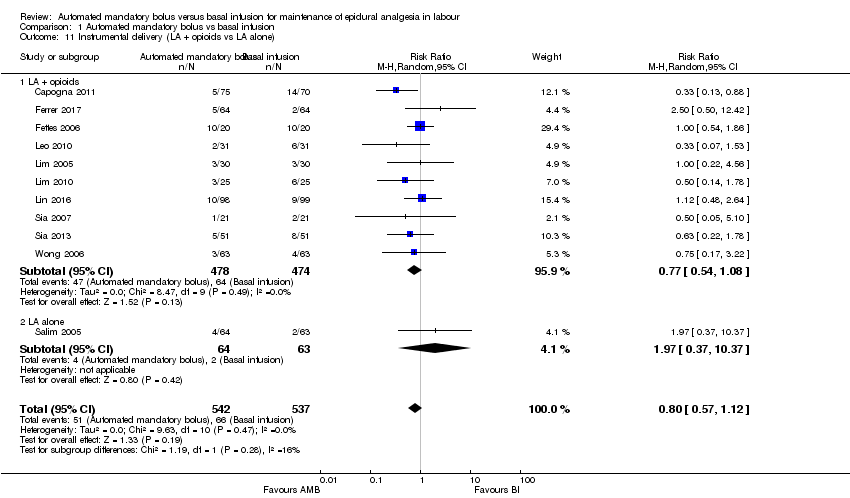
Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 11 Instrumental delivery (LA + opioids vs LA alone).
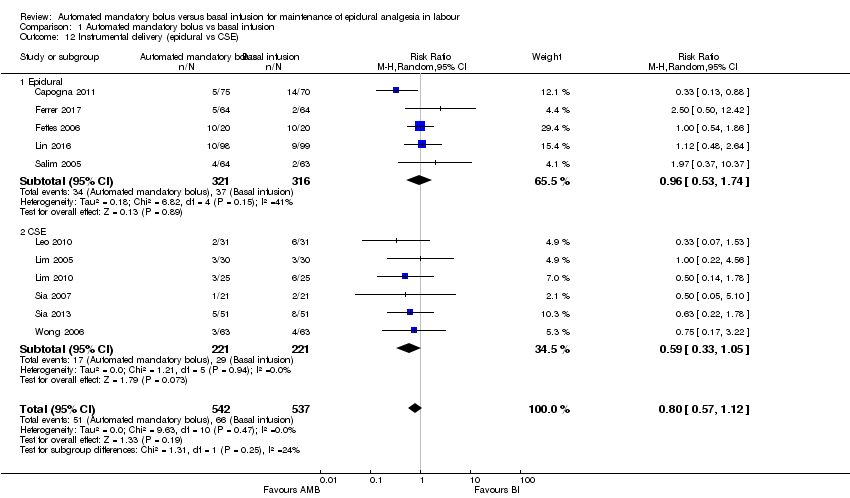
Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 12 Instrumental delivery (epidural vs CSE).
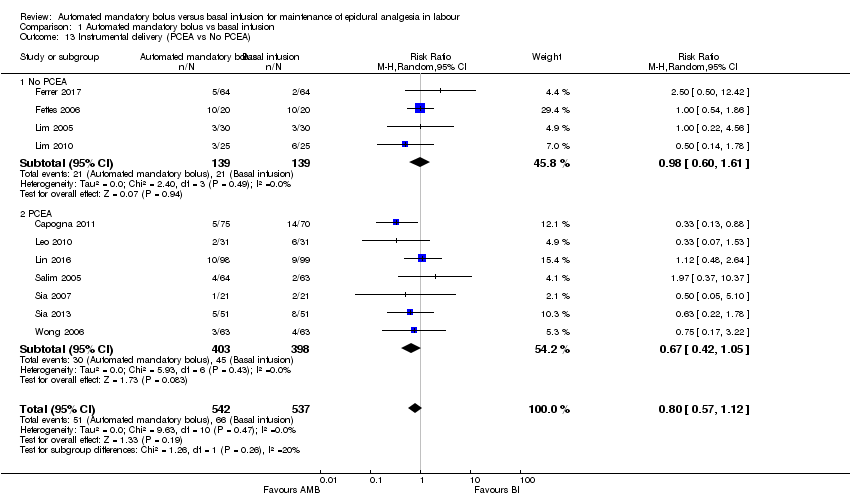
Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 13 Instrumental delivery (PCEA vs No PCEA).
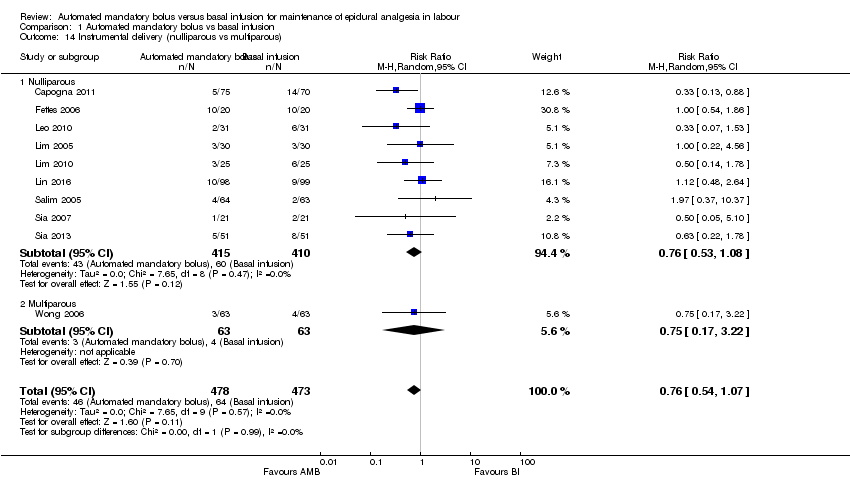
Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 14 Instrumental delivery (nulliparous vs multiparous).

Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 15 Duration of labour in minutes.
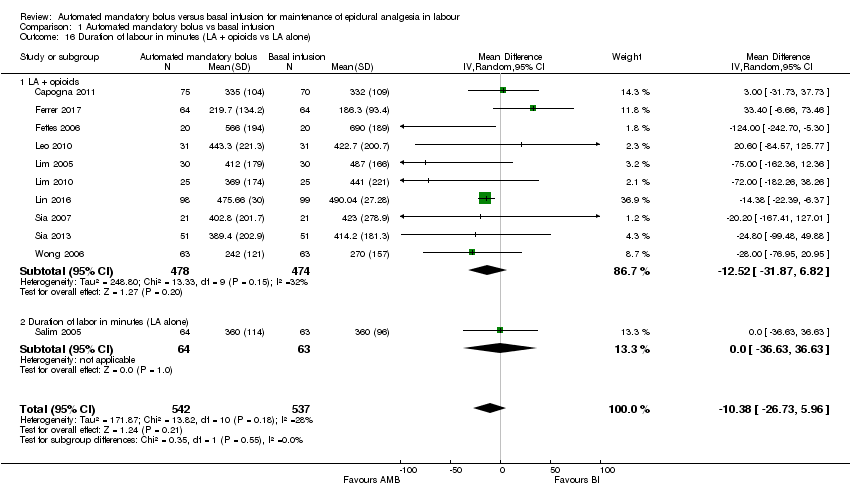
Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 16 Duration of labour in minutes (LA + opioids vs LA alone).
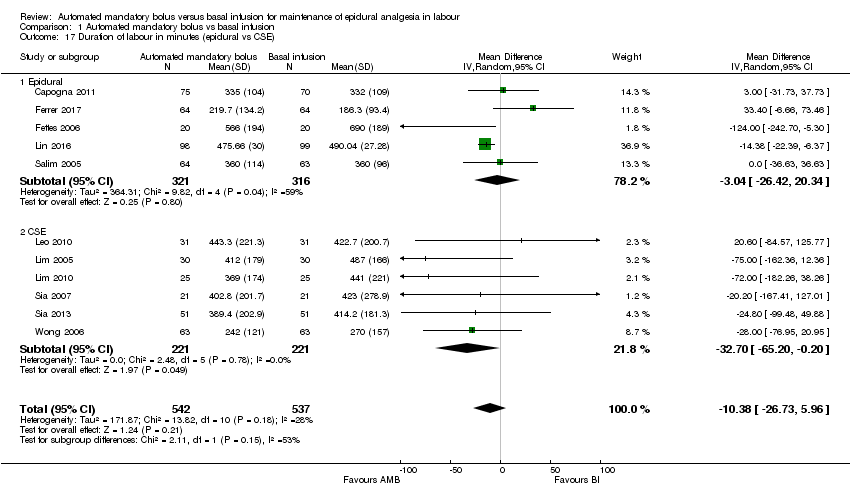
Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 17 Duration of labour in minutes (epidural vs CSE).
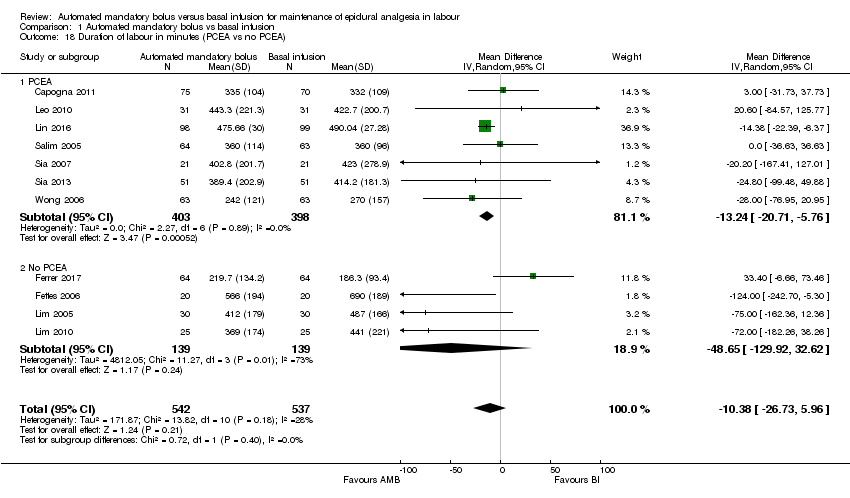
Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 18 Duration of labour in minutes (PCEA vs no PCEA).

Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 19 Duration of labour in minutes (nulliparous vs multiparous).

Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 20 LA consumption per hour.

Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 21 LA consumption per hour (LA + opioids vs LA alone).

Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 22 LA consumption per hour (epidural vs CSE).

Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 23 LA consumption per hour (PCEA vs no PCEA).
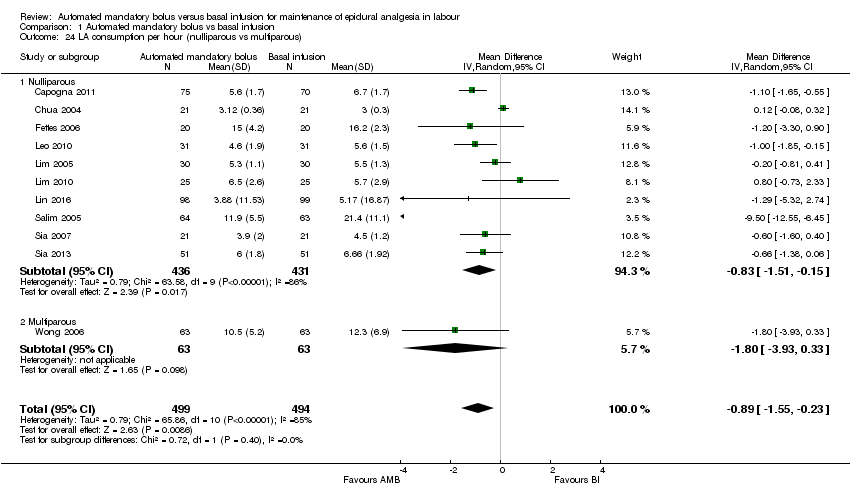
Comparison 1 Automated mandatory bolus vs basal infusion, Outcome 24 LA consumption per hour (nulliparous vs multiparous).
| Automated mandatory bolus versus basal infusion for maintenance of epidural analgesia in labour | |||||
| Patient or population: maintenance of epidural analgesia in labour | |||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | |
| Risk with basal infusion | Risk with automated mandatory bolus | ||||
| Breakthrough pain | Study population | RR 0.60 | 797 | ⊕⊕⊕⊝ | |
| 333 per 1000 | 200 per 1000 | ||||
| Caesarean delivery | Study population | RR 0.92 | 1079 | ⊕⊕⊝⊝ | |
| 160 per 1000 | 147 per 1000 | ||||
| Instrumental delivery | Study population | RR 0.75 | 1079 | ⊕⊕⊝⊝ | |
| 123 per 1000 | 92 per 1000 | ||||
| Duration of labour in min | The mean duration of labour in min ranged from 186.3 to 690.0 min | MD 10.38 min lower | — | 1079 | ⊕⊕⊕⊝ |
| LA consumption per hour | The mean LA consumption per hour ranged from 3 mg to 21.4 mg | MD 1.08 mg/h lower | — | 1121 | ⊕⊕⊕⊝ |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence | |||||
| aDowngraded one level due to considerable statistical heterogeneity for this outcome, i.e. I2 = 69%. | |||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Breakthrough pain Show forest plot | 10 | 797 | Risk Ratio (M‐H, Random, 95% CI) | 0.60 [0.39, 0.92] |
| 2 Breakthrough pain (epidural vs CSE) Show forest plot | 10 | 797 | Risk Ratio (M‐H, Random, 95% CI) | 0.60 [0.39, 0.92] |
| 2.1 Epidural | 3 | 313 | Risk Ratio (M‐H, Random, 95% CI) | 0.40 [0.25, 0.64] |
| 2.2 CSE | 7 | 484 | Risk Ratio (M‐H, Random, 95% CI) | 0.71 [0.44, 1.13] |
| 3 Breakthrough pain (PCEA vs no PCEA) Show forest plot | 10 | 797 | Risk Ratio (M‐H, Random, 95% CI) | 0.60 [0.39, 0.92] |
| 3.1 PCEA | 5 | 477 | Risk Ratio (M‐H, Random, 95% CI) | 0.61 [0.35, 1.07] |
| 3.2 No PCEA | 5 | 320 | Risk Ratio (M‐H, Random, 95% CI) | 0.58 [0.30, 1.12] |
| 4 Breakthrough pain (nulliparous vs multiparous) Show forest plot | 9 | 669 | Risk Ratio (M‐H, Random, 95% CI) | 0.62 [0.39, 1.00] |
| 4.1 Nulliparous | 8 | 543 | Risk Ratio (M‐H, Random, 95% CI) | 0.62 [0.33, 1.15] |
| 4.2 Multiparous | 1 | 126 | Risk Ratio (M‐H, Random, 95% CI) | 0.59 [0.38, 0.90] |
| 5 Caesarean delivery Show forest plot | 11 | 1079 | Risk Ratio (M‐H, Random, 95% CI) | 0.92 [0.70, 1.21] |
| 6 Caesarean delivery (LA + opioids vs LA alone) Show forest plot | 11 | 1079 | Risk Ratio (M‐H, Random, 95% CI) | 0.92 [0.70, 1.21] |
| 6.1 LA + opioids | 10 | 952 | Risk Ratio (M‐H, Random, 95% CI) | 0.93 [0.70, 1.24] |
| 6.2 LA alone | 1 | 127 | Risk Ratio (M‐H, Random, 95% CI) | 0.74 [0.27, 2.01] |
| 7 Caesarean delivery (epidural vs CSE) Show forest plot | 11 | 1079 | Risk Ratio (M‐H, Random, 95% CI) | 0.92 [0.70, 1.21] |
| 7.1 Epidural | 5 | 637 | Risk Ratio (M‐H, Random, 95% CI) | 0.78 [0.53, 1.15] |
| 7.2 CSE | 6 | 442 | Risk Ratio (M‐H, Random, 95% CI) | 1.08 [0.73, 1.59] |
| 8 Caesarean delivery (PCEA vs no PCEA) Show forest plot | 11 | 1079 | Risk Ratio (M‐H, Random, 95% CI) | 0.92 [0.70, 1.21] |
| 8.1 PCEA | 7 | 801 | Risk Ratio (M‐H, Random, 95% CI) | 0.98 [0.70, 1.37] |
| 8.2 No PCEA | 4 | 278 | Risk Ratio (M‐H, Random, 95% CI) | 0.81 [0.50, 1.30] |
| 9 Caesarean delivery (nulliparous vs multiparous) Show forest plot | 10 | 951 | Risk Ratio (M‐H, Random, 95% CI) | 0.93 [0.70, 1.25] |
| 9.1 Nulliparous | 9 | 825 | Risk Ratio (M‐H, Random, 95% CI) | 0.92 [0.69, 1.23] |
| 9.2 Multiparous | 1 | 126 | Risk Ratio (M‐H, Random, 95% CI) | 3.0 [0.12, 72.27] |
| 10 Instrumental delivery Show forest plot | 11 | 1079 | Risk Ratio (M‐H, Random, 95% CI) | 0.75 [0.54, 1.06] |
| 11 Instrumental delivery (LA + opioids vs LA alone) Show forest plot | 11 | 1079 | Risk Ratio (M‐H, Random, 95% CI) | 0.80 [0.57, 1.12] |
| 11.1 LA + opioids | 10 | 952 | Risk Ratio (M‐H, Random, 95% CI) | 0.77 [0.54, 1.08] |
| 11.2 LA alone | 1 | 127 | Risk Ratio (M‐H, Random, 95% CI) | 1.97 [0.37, 10.37] |
| 12 Instrumental delivery (epidural vs CSE) Show forest plot | 11 | 1079 | Risk Ratio (M‐H, Random, 95% CI) | 0.80 [0.57, 1.12] |
| 12.1 Epidural | 5 | 637 | Risk Ratio (M‐H, Random, 95% CI) | 0.96 [0.53, 1.74] |
| 12.2 CSE | 6 | 442 | Risk Ratio (M‐H, Random, 95% CI) | 0.59 [0.33, 1.05] |
| 13 Instrumental delivery (PCEA vs No PCEA) Show forest plot | 11 | 1079 | Risk Ratio (M‐H, Random, 95% CI) | 0.80 [0.57, 1.12] |
| 13.1 No PCEA | 4 | 278 | Risk Ratio (M‐H, Random, 95% CI) | 0.98 [0.60, 1.61] |
| 13.2 PCEA | 7 | 801 | Risk Ratio (M‐H, Random, 95% CI) | 0.67 [0.42, 1.05] |
| 14 Instrumental delivery (nulliparous vs multiparous) Show forest plot | 10 | 951 | Risk Ratio (M‐H, Random, 95% CI) | 0.76 [0.54, 1.07] |
| 14.1 Nulliparous | 9 | 825 | Risk Ratio (M‐H, Random, 95% CI) | 0.76 [0.53, 1.08] |
| 14.2 Multiparous | 1 | 126 | Risk Ratio (M‐H, Random, 95% CI) | 0.75 [0.17, 3.22] |
| 15 Duration of labour in minutes Show forest plot | 11 | 1079 | Mean Difference (IV, Random, 95% CI) | ‐10.38 [‐26.73, 5.96] |
| 16 Duration of labour in minutes (LA + opioids vs LA alone) Show forest plot | 11 | 1079 | Mean Difference (IV, Random, 95% CI) | ‐10.38 [‐26.73, 5.96] |
| 16.1 LA + opioids | 10 | 952 | Mean Difference (IV, Random, 95% CI) | ‐12.52 [‐31.87, 6.82] |
| 16.2 Duration of labor in minutes (LA alone) | 1 | 127 | Mean Difference (IV, Random, 95% CI) | 0.0 [‐36.63, 36.63] |
| 17 Duration of labour in minutes (epidural vs CSE) Show forest plot | 11 | 1079 | Mean Difference (IV, Random, 95% CI) | ‐10.38 [‐26.73, 5.96] |
| 17.1 Epidural | 5 | 637 | Mean Difference (IV, Random, 95% CI) | ‐3.04 [‐26.42, 20.34] |
| 17.2 CSE | 6 | 442 | Mean Difference (IV, Random, 95% CI) | ‐32.70 [‐65.20, ‐0.20] |
| 18 Duration of labour in minutes (PCEA vs no PCEA) Show forest plot | 11 | 1079 | Mean Difference (IV, Random, 95% CI) | ‐10.38 [‐26.73, 5.96] |
| 18.1 PCEA | 7 | 801 | Mean Difference (IV, Random, 95% CI) | ‐13.24 [‐20.71, ‐5.76] |
| 18.2 No PCEA | 4 | 278 | Mean Difference (IV, Random, 95% CI) | ‐48.65 [‐129.92, 32.62] |
| 19 Duration of labour in minutes (nulliparous vs multiparous) Show forest plot | 10 | 951 | Mean Difference (IV, Random, 95% CI) | ‐14.38 [‐21.80, ‐6.96] |
| 19.1 Nulliparous | 9 | 825 | Mean Difference (IV, Random, 95% CI) | ‐13.92 [‐23.75, ‐4.10] |
| 19.2 Multiparous | 1 | 126 | Mean Difference (IV, Random, 95% CI) | ‐28.0 [‐76.95, 20.95] |
| 20 LA consumption per hour Show forest plot | 12 | 1121 | Mean Difference (IV, Random, 95% CI) | ‐1.08 [‐1.78, ‐0.38] |
| 21 LA consumption per hour (LA + opioids vs LA alone) Show forest plot | 12 | 1121 | Mean Difference (IV, Random, 95% CI) | ‐1.08 [‐1.78, ‐0.38] |
| 21.1 LA + opioids | 11 | 994 | Mean Difference (IV, Random, 95% CI) | ‐0.75 [‐1.35, ‐0.15] |
| 21.2 LA alone | 1 | 127 | Mean Difference (IV, Random, 95% CI) | ‐9.50 [‐12.55, ‐6.45] |
| 22 LA consumption per hour (epidural vs CSE) Show forest plot | 12 | 1121 | Mean Difference (IV, Random, 95% CI) | ‐1.08 [‐1.78, ‐0.38] |
| 22.1 Epidural | 5 | 637 | Mean Difference (IV, Random, 95% CI) | ‐2.59 [‐4.13, ‐1.05] |
| 22.2 CSE | 7 | 484 | Mean Difference (IV, Random, 95% CI) | ‐0.35 [‐0.80, 0.11] |
| 23 LA consumption per hour (PCEA vs no PCEA) Show forest plot | 12 | 1121 | Mean Difference (IV, Random, 95% CI) | ‐1.08 [‐1.78, ‐0.38] |
| 23.1 PCEA | 7 | 801 | Mean Difference (IV, Random, 95% CI) | ‐1.59 [‐2.58, ‐0.60] |
| 23.2 No PCEA | 5 | 320 | Mean Difference (IV, Random, 95% CI) | ‐0.53 [‐1.58, 0.52] |
| 24 LA consumption per hour (nulliparous vs multiparous) Show forest plot | 11 | 993 | Mean Difference (IV, Random, 95% CI) | ‐0.89 [‐1.55, ‐0.23] |
| 24.1 Nulliparous | 10 | 867 | Mean Difference (IV, Random, 95% CI) | ‐0.83 [‐1.51, ‐0.15] |
| 24.2 Multiparous | 1 | 126 | Mean Difference (IV, Random, 95% CI) | ‐1.80 [‐3.93, 0.33] |

