Histerectomía con radioterapia o quimioterapia o ambos para pacientes con cáncer de cuello de útero localmente avanzado
Resumen
Antecedentes
El cáncer de cuello de útero es el segundo cáncer más frecuente en mujeres de hasta 65 años de edad y es la causa más frecuente de muerte por cáncer ginecológico en todo el mundo. Las fuentes indican que una proporción muy alta de nuevos casos de cáncer de cuello de útero en los países en desarrollo se detectan en un estadio avanzado (IB2 o más) y más de la mitad de estos pueden estar en estadio III o IV. El estadiaje del cáncer de cuello de útero se basa en los resultados del examen clínico (estadiaje FIGO). La atención estándar en Europa y EE. UU. para el estadio IB2 a III es el tratamiento no quirúrgico (quimiorradiación). Sin embargo, en los países en desarrollo, donde el acceso a la radioterapia es limitado, el cáncer de cuello de útero localmente avanzado puede ser tratado con una combinación de quimioterapia e histerectomía (cirugía para extraer el útero y el cuello del útero, con o sin los tejidos circundantes). No hay certeza de que este procedimiento mejore la supervivencia. Por lo tanto, es importante evaluar de manera sistemática el valor de la histerectomía además de la radioterapia o la quimioterapia, o ambas, como una intervención alternativa en el tratamiento del cáncer de cuello de útero localmente avanzado (estadio IB2 a III).
Objetivos
Determinar si la histerectomía, además del tratamiento estándar con radiación o quimioterapia, o ambos, en pacientes con cáncer de cuello de útero localmente avanzado (estadio IB2 a III) es segura y eficaz en comparación con el tratamiento estándar solo.
Métodos de búsqueda
Se hicieron búsquedas en el registro de ensayos del Grupo Cochrane de Cáncer Ginecológico (Cochrane Gynaecological Cancer Group), MEDLINE, EMBASE y LILACS hasta febrero 2014. También se buscó en los registros de ensayos clínicos, los resúmenes de reuniones científicas y en las listas de referencias de los estudios incluidos.
Criterios de selección
Se buscaron ensayos controlados aleatorios (ECA) que compararan protocolos de tratamiento que incluyeran histerectomía versus radioterapia o quimioterapia, o ambas, en pacientes con cáncer de cuello de útero en estadio avanzado (IB2 a III) que se presentaban por primera vez.
Obtención y análisis de los datos
Se evaluó la elegibilidad de los estudios de forma independiente, se extrajeron los datos y se evaluó el riesgo de sesgo. Cuando fue posible, los resultados de supervivencia general y de supervivencia libre de progresión o de enfermedad se sintetizaron en un metanálisis mediante el modelo de efectos aleatorios. Los eventos adversos no se informaron completamente, por lo que los resultados de los ensayos individuales se describieron de forma narrativa.
Resultados principales
Se incluyeron siete ECA (1217 mujeres) de diversa calidad metodológica en la revisión; la mayoría de los ensayos presentaban un riesgo de sesgo moderado o alto.
Tres fueron ensayos multicéntricos, dos fueron ensayos de centro único y en dos ensayos no estuvo claro si fueron multicéntricos o de centro único. Estos ensayos compararon las siguientes intervenciones en pacientes con cáncer de cuello de útero localmente avanzado (estadios IB2 a III):
histerectomía (simple o radical) con radioterapia (n = 194) versus radioterapia sola (n = 180); histerectomía (simple o radical) con quimiorradioterapia (n = 31) versus quimiorradioterapia sola (n = 30); histerectomía (radical) con quimiorradioterapia (n = 111) versus radioterapia interna con quimiorradioterapia (n = 100); histerectomía (simple o radical) con quimioterapia por adelantado (neoadyuvante) (n = 298) versus radioterapia sola (n = 273).
Un ensayo (n = 256) no encontró diferencias en el riesgo de muerte o progresión de la enfermedad entre las pacientes que recibieron radioterapia atenuada seguida de histerectomía y las que recibieron radioterapia (externa e interna) sola (cociente de riesgos instantáneos [CRI] 0,89; intervalo de confianza [IC] del 95%: 0,61 a 1,29). Este ensayo tampoco informó diferencias entre los dos grupos en cuanto a los efectos adversos (18/129 efectos adversos grado 3 ó 4 en el grupo de histerectomía y radiación y 19 casos en 18/121 mujeres del grupo de radioterapia sola). No hubo diferencias en la supervivencia actuarial sin tumor a los cinco años (representación de los años probables de supervivencia de una población definida de participantes), ni en las complicaciones graves (grado 3) en otro ensayo (n = 118) que informó la misma comparación (6/62 versus 6/56 en el grupo de radiación con cirugía versus el grupo de radioterapia sola, respectivamente). La calidad de las pruebas era baja para todos estos resultados.
Un ensayo (n = 61) no informó diferencias (valor de p > 0,10) en la supervivencia general y sin recidiva a los tres años entre quimiorradioterapia e histerectomía versus quimiorradioterapia sola (pruebas de calidad baja). No se informaron los eventos adversos y la morbilidad.
De manera similar, otro ensayo (n = 211) no encontró diferencias en el riesgo de muerte (CRI 0,65; IC del 95%: 0,35 a 1,21; valor de p = 0,19, pruebas de calidad baja), progresión de la enfermedad (CRI 0,70; IC del 95%: 0,31 a 1,34; valor de p = 0,24, pruebas de calidad baja) o complicaciones graves tardías (valor de p = 0,53, pruebas de calidad baja) entre las pacientes que recibieron radioterapia interna versus histerectomía después que ambos grupos habían recibido quimiorradioterapia de haz externo.
El metanálisis de tres ensayos de quimioterapia neoadyuvante e histerectomía versus radioterapia sola, que evaluó a 571 participantes, encontró que las pacientes que recibieron quimioterapia neoadyuvante más histerectomía tuvieron menos riesgo de muerte que las que recibieron radioterapia sola (CRI 0,71; IC del 95%: 0,55 a 0,93; I2 = 0%, pruebas de calidad moderada). Sin embargo, un número significativo de participantes que recibieron quimioterapia neoadyuvante más histerectomía recibieron también radioterapia. No hubo diferencias en la proporción de pacientes con progresión de la enfermedad o recidiva entre los dos grupos (CR 0,75; IC del 95%: 0,53 a 1,05; I2 = 20%, pruebas de calidad moderada).
Los resultados de los ensayos individuales no informaron diferencias evidentes (valor de p > 0,05) en las complicaciones graves a largo plazo, la toxicidad aguda grado 3 y la toxicidad grave tardía entre los dos grupos (pruebas de calidad baja).
Los resultados de calidad de vida no se informaron en ninguno de los ensayos.
Conclusiones de los autores
A partir de los ECA disponibles no se encontraron pruebas suficientes de que la histerectomía con radioterapia, con o sin quimioterapia, mejore la supervivencia de las pacientes con cáncer de cuello de útero localmente avanzado que son tratadas con radioterapia o quimiorradioterapia sola. La calidad general de las pruebas fue variable entre los diferentes resultados y se disminuyó de forma general debido a inquietudes con respecto al riesgo de sesgo. La calidad de las pruebas de quimioterapia neoadyuvante e histerectomía radical versus radioterapia sola para los resultados de supervivencia fue moderada, con pruebas de otras comparaciones de calidad baja. Lo anterior se basó principalmente en el informe deficiente y la escasez de datos cuando los resultados se basaron en ensayos individuales. Más ensayos que evalúen el tratamiento médico con y sin histerectomía pueden probar la solidez de los resultados de esta revisión, ya que es probable que estudios de investigación adicionales tengan una marcada repercusión sobre la confianza en la estimación del efecto.
PICOs
Resumen en términos sencillos
Histerectomía con tratamiento médico para el cáncer de cuello de útero que se ha diseminado a los tejidos vecinos solamente
El problema
El cáncer de cuello de útero (cáncer cervical) es el cáncer más frecuente entre las mujeres hasta los 65 años de edad. A una proporción alta de mujeres en los países en desarrollo se les diagnostica una enfermedad localmente avanzada (diseminación a los tejidos vecinos, pero sin diseminación distante obvia). Generalmente son tratadas con radioterapia, con o sin quimioterapia (tratamiento médico). También se utiliza la histerectomía (cirugía para extraer la matriz y el cuello uterino) con tratamiento médico, especialmente en los países en desarrollo, donde el acceso a la radioterapia es limitado.
El objetivo de la revisión
¿La histerectomía con tratamiento médico es más beneficiosa en comparación con el tratamiento médico solo en el cáncer de cuello de útero localmente avanzado?
¿Cómo se realizó la revisión?
Una búsqueda en la literatura desde 1966 a febrero 2014 identificó siete ensayos con un riesgo de sesgo de moderado a alto. Éstos incluyeron 1217 mujeres y compararon: histerectomía con radioterapia versus radioterapia sola; histerectomía con quimiorradioterapia versus quimiorradioterapia sola; histerectomía con quimiorradioterapia versus radioterapia interna (braquiterapia) con quimiorradioterapia; e histerectomía con quimioterapia previa (neoadyuvante) versus radioterapia sola.
¿Cuáles son los principales hallazgos?
Dos estudios, que incluyeron 374 pacientes, compararon radioterapia preoperatoria e histerectomía versus radioterapia sola, pero solamente un ensayo informó la supervivencia general, sin diferencia entre los grupos. Estos estudios no encontraron diferencias en el riesgo de progresión de la enfermedad (o muerte) o la supervivencia sin tumor a los cinco años.
Un estudio, que incluyó 61 pacientes, no informó diferencias en la supervivencia general y sin recidiva entre quimioterapia e histerectomía versus quimiorradioterapia sola.
Otro estudio que comparó radioterapia interna (braquiterapia) versus histerectomía en 211 pacientes que recibieron quimiorradioterapia no encontró diferencias en el riesgo de muerte o progresión de la enfermedad.
Al combinar los resultados de tres de los estudios independientes que evaluaron a 571 pacientes se encontró que menos pacientes que recibieron quimioterapia neoadyuvante más histerectomía murieron que entre las que recibieron radioterapia sola. Sin embargo, muchas mujeres en el primer grupo también recibieron radioterapia. No hubo diferencias en el número de pacientes que estuvieron libres de enfermedad después del tratamiento.
Los eventos adversos no se informaron de manera completa. Los resultados de los ensayos individuales no mostraron diferencias en los eventos adversos graves entre los dos grupos en cualquier comparación. Datos limitados indicaron que las intervenciones parecieron tolerarse razonablemente bien, aunque se necesitan más pruebas.
No se informaron medidas sobre la calidad de vida.
¿Cuáles son las conclusiones?
No se encontraron pruebas suficientes de que la histerectomía agregada a la radiación y la quimiorradiación mejorara la supervivencia, la calidad de vida o los eventos adversos en el cáncer de cuello de útero localmente avanzado en comparación con tratamiento médico solo. En general, la calidad de las pruebas fue variable y se disminuyó en general debido a inquietudes con respecto al riesgo de sesgo. La calidad de las pruebas de quimioterapia neoadyuvante e histerectomía radical versus radioterapia sola para los resultados de supervivencia fue moderada, con pruebas de otras comparaciones que fueron de calidad baja. Es probable que los datos adicionales de ensayos planificados cuidadosamente que evalúen el tratamiento médico con y sin histerectomía repercutan en la seguridad acerca de estos resultados.
Conclusiones de los autores
Summary of findings
| Neoadjuvant chemotherapy and radical hysterectomy compared with radiotherapy alone for women with locally advanced cervical cancer | ||||
| Patient or population: Women with locally advanced cervical cancer Settings: Outpatient Intervention: Neoadjuvant chemotherapy and radical hysterectomy Comparison: Radiotherapy alone | ||||
| Outcomes | Relative effect | No of Participants | Quality of the evidence | Comments |
| Overall survival Median follow‐up ranged from 39 to 60 months in the 3 trials | HR 0.71 (0.55 to 0.93) | 571 | ⊕⊕⊕⊝ | Downgraded due to concerns regarding the uncertainty of risk of bias in individual trials |
| Disease or progression‐free survival Median follow‐up ranged from 39 to 60 months in the 3 trials | HR 0.75 (0.53 to 1.05) | 571 | ⊕⊕⊕⊝ | Downgraded due to concerns regarding the uncertainty of risk of bias in individual trials and varying definitions of disease and progression‐free survival. Although we did not feel the latter merited a further downgrade to low quality evidence |
| Severe adverse events and toxicity | Acute severe toxicity: RR 1.32, (0.47 to 3.71) long‐term severe complications: RR 0.86 (0.49 to 1.50) Severe late toxicity: RR 0.60 (0.27 to 1.34) | Acute toxicity 118 (1 RCT) Long‐term severe complications 409 (1 RCT) Severe late toxicity: 118 (1 RCT) | ⊕⊕⊝⊝ | Downgraded due to incomplete and poor reporting of important adverse events and toxicities and sparseness of data |
| GRADE Working Group grades of evidence | ||||
Antecedentes
Descripción de la afección
El cáncer de cuello uterino es el segundo cáncer más frecuente entre las mujeres de hasta 65 años de edad y es la causa más frecuente de muerte por cáncer ginecológico en todo el mundo (GLOBOCAN 2013). La introducción en 1988 de un programa nacional de detección de cáncer de cuello de útero en el Reino Unido dio lugar, en una década, a la reducción a la mitad en la incidencia de cáncer de cuello de útero, de una tasa de incidencia estandarizada por la edad (TIEE) de 16,2 por 100 000 a una TIEE de 8,3 por 100 000 en 2008 (NCIN 2010). Además, la mortalidad por cáncer de cuello de útero ha descendido en muchos países desarrollados durante las dos últimas décadas (GLOBOCAN 2013), en particular en los países con programas organizados de detección de cáncer de cuello de útero (Laara 1987; Quinn 1999). A pesar de éxitos similares en otros países, el cáncer de cuello de útero todavía es un problema internacional importante.
En muchos países en desarrollo, el acceso a los servicios sanitarios es limitado y el cribado del cáncer de cuello de útero no existe o no está al alcance de las mujeres que lo necesitan. En estas áreas, el cáncer de cuello de útero es el cáncer más frecuente en las mujeres y la principal causa de muerte debido a cáncer (Mothers 2008). Un informe de un país en desarrollo ha mostrado que más del 80% de los nuevos casos de cáncer de cuello de útero se encuentran en estadios avanzados (IB2 o más), y más de la mitad están en estadio III a IV (Khuhaprema 2010). En 2012, cerca de 265 000 mujeres murieron por la enfermedad y más del 87,8% vivía en países en desarrollo(GLOBOCAN 2013). En Europa, aproximadamente el 60% de las mujeres con cáncer de cuello de útero sobreviven cinco años después del diagnóstico (EUROCARE 2003). La enfermedad residual o recurrente aparece con frecuencia después del tratamiento inicial en más del 50% de los cánceres de cuello de útero estadio III a IVA, lo que provoca mortalidad (Apéndice 1).
El cáncer de cuello de útero se clasifica según el sistema de la International Federation of Gynecology and Obstetrics (FIGO)(Benedet 2003), que se basa en los resultados del examen clínico (ver Apéndice 1 para descripciones de la enfermedad en diferentes estadios FIGO). En esta revisión, las pacientes con cáncer de cuello de útero estadio FIGO IB2 a III (localmente avanzado) fueron la población de interés.
Descripción de la intervención
Las decisiones de tratamiento para el cáncer invasivo del cuello uterino se deben individualizar y basar en factores como la edad, la condición médica de las pacientes, el estadio de la enfermedad y otros factores relacionados con el tumor para lograr la mejor curación con complicaciones mínimas (Kesic 2006). Como regla general, las formas de tratamiento múltiples tienen más complicaciones potenciales y efectos secundarios que una forma de tratamiento única.
En el estadio IA1, se pueden utilizar los tratamientos cervicales locales (extracción amplia con asa o aguja de la zona de transformación [en inglés, LLETZ/NETZ], la biopsia por cono con bisturí) o la histerectomía total (cirugía para extraer el útero y el cuello del útero), según las preferencias y las aspiraciones con respecto a la fertilidad de las pacientes.
En el estadio IA2 a IB1, la histerectomía radical con linfadenectomía pelviana o la quimiorradioterapia han sido las formas de tratamiento aceptadas con eficacias similares informadas (Eifel 1993). Este resultado se apoyó principalmente en un ensayo controlado aleatorio (ECA) antes de la era de la quimiorradioterapia concurrente (Landoni 1997). En las pacientes más jóvenes se prefiere la cirugía, en parte debido a la ventaja de preservar la función ovárica.
La histerectomía radical, junto con la linfadenectomía pelviana bilateral, incluye la extracción del útero, el cuello uterino, la parte superior de la vagina y los tejidos alrededor del cuello uterino (tejido parametrial), así como los ganglios linfáticos (glándulas) en la pelvis para ver si contienen cáncer (linfadenectomía pelviana). Aunque este tipo de cirugía tiene resultados excelentes, puede dar lugar a efectos secundarios, como lesión en los órganos (vejiga, intestino, vasos sanguíneos, nervios) y efectos secundarios a largo plazo, como disfunción sexual o vesical, formación de quistes pelvianos y linfedema (edema) en las piernas.
La traquelectomía radical puede ser una alternativa a la histerectomía radical en las pacientes que quieren preservar la fertilidad, a condición de que cumplan ciertos criterios. Estos son, tamaño tumoral no mayor de 2 cm y sin metástasis a los ganglios linfáticos regionales (Shepherd 2012). La traquelectomía radical incluye la extracción del cuello uterino, la parte superior de la vagina y el tejido parametrial y las glándulas linfáticas pelvianas. Este tratamiento está bien establecido, parece ser seguro y efectivo para preservar la fertilidad, y las posibilidades de concepción son altas. El aborto espontáneo tardío y el trabajo de parto prematuro son los efectos secundarios más graves en los embarazos en pacientes a las que se les ha realizado una traquelectomía.
En los tumores de estadio IB2 y mayor, la incidencia de metástasis de los ganglios linfáticos aumenta significativamente, así como la incidencia de recidivas centrales, regionales y distantes (Alvarez 1989; Burghardt 1978; Chung 1980; Delgado 1990; Piver 1975). Si se selecciona un enfoque quirúrgico puede haber dificultades al extraer todo el tumor con un margen de tejido normal (que es la cirugía adecuada), por lo que hay una probabilidad alta de necesitar tratamiento adicional (radioterapia con o sin quimioterapia), con el aumento en la morbilidad del tratamiento combinado. En las pacientes con enfermedad estadio FIGO IB2 y mayor, la quimiorradioterapia es actualmente la atención estándar; ha mostrado mejorar la supervivencia libre de enfermedad, la supervivencia libre de progresión y la supervivencia general (CCMAC 2010; Keys 1999; NCI 1999). Incluye la administración de quimioterapia con cisplatino durante el ciclo de radioterapia, administrada en el transcurso de siete semanas. La quimioterapia hace a las células cancerosas más sensibles a la radioterapia y, por lo tanto, mejora los resultados del tratamiento.
Sin embargo, en el cáncer de cuello de útero localmente avanzado (estadio IB2 a III) se ha considerado la cirugía en los casos siguientes:
-
después de quimiorradioterapia, en las pacientes que no han logrado una remisión completa en el transcurso de dos a tres meses después del tratamiento, el tumor es oncológicamente operable y la paciente está clínicamente apta para someterse a cirugía adicional;
-
después de utilizar radioterapia o quimioterapia para reducir el tumor cervical a un tamaño en el que se pueda extraer con márgenes normales;
-
después de quimioterapia neoadyuvante (quimioterapia administrada antes que otros tratamientos para reducir el tamaño del tumor), especialmente en los países en desarrollo con acceso limitado a la radioterapia, pero no está claro si ofrece un beneficio sobre la cirugía sola o la quimiorradioterapia (Rydzewska 2012).
El cáncer de cuello de útero en estadio IVA, cuando el cáncer se ha diseminado a la vejiga o al recto adyacentes, generalmente se trata con quimiorradioterapia (CCMAC 2010). Algunos autores han indicado que la quimioterapia neoadyuvante seguida de cirugía radical (incluida la extracción de la vejiga o el recto afectados) quizás sea una alternativa válida al tratamiento estándar (Benedetti Panicci 2007).
En el estadio IVB, el objetivo del tratamiento es generalmente la radioterapia y la quimioterapia paliativas (Kesic 2006; NCI 2014).
De qué manera podría funcionar la intervención
Aunque la resección quirúrgica de las formas avanzadas no metastásicas de cáncer de cuello de útero es polémica, puede ayudar a mejorar el control local (Houvenaeghel 1998). Muchos estudios informan resultados favorables de la histerectomía en pacientes con cáncer de cuello de útero avanzado después de radioterapia (Classe 2006; Kornovski 2007; Leino 1994; Noterman 2006 Potish 1990; Tsuda 2001; Wang 2002). No está claro si se necesita una histerectomía total simple(Leino 1994; Potish 1990; Wang 2002) o una histerectomía radical(Classe 2006; Kornovski 2007; Noterman 2006; Tsuda 2001; Wang 2002) (Noterman 2006).
El tratamiento multimodal de histerectomía combinada con quimioterapia o radioterapia, o ambas, puede mejorar la supervivencia; pero puede (Touboul 2010) o no (Classe 2006; Perez 1987) causar eventos adversos significativamente peores en comparación con radioterapia o quimiorradioterapia sola.
Por qué es importante realizar esta revisión
Es importante evaluar la histerectomía además de quimioterapia, radioterapia o quimiorradioterapia en el tratamiento del cáncer de cuello de útero localmente avanzado.
Objetivos
Determinar si la histerectomía, además del tratamiento estándar con radiación o quimioterapia, o ambos, en pacientes con cáncer de cuello de útero localmente avanzado (estadio IB2 a III) es segura y eficaz en comparación con el tratamiento estándar solo.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Ensayos controlados con asignación aleatoria (ECA)
Tipos de participantes
Pacientes adultas (18 años o más) con cánceres cervicouterinos localmente avanzados (estadio IB2 a III)
Tipos de intervenciones
Se comparó la histerectomía en combinación con tratamiento neoadyuvante, concurrente o coadyuvante versus intervenciones no quirúrgicas.
-
Histerectomía (simple o radical) con radioterapia versus radioterapia sola.
-
Histerectomía (simple o radical) con quimiorradioterapia versus quimiorradioterapia sola.
-
Histerectomía (radical) con quimiorradioterapia versus radioterapia interna (braquiterapia) con quimiorradioterapia.
-
Histerectomía (simple o radical) con quimioterapia neoadyuvante versus radioterapia sola.
Tipos de medida de resultado
Resultados primarios
-
Supervivencia general: la supervivencia hasta la muerte por cualquier causa se evaluó desde el momento en que las pacientes ingresaron al estudio, o como la definieron los autores de los ensayos
Resultados secundarios
-
Supervivencia libre de progresión
-
Si los autores informaron sobre la supervivencia libre de enfermedad en lugar de la supervivencia libre de progresión entonces fue esta la que se evaluó
-
Calidad de vida, medida con una escala validada mediante el informe de normas, contra una escala validada en una publicación revisada por pares
-
Eventos adversos
Complicaciones relacionadas con la cirugía
Medidas como la proporción de pacientes que desarrollaron uno de los ítems siguientes (según la definición de los estudios) en el transcurso de 12 semanas.
Estas complicaciones se clasificaron como tempranas (antes del alta hospitalaria o en el transcurso de siete días de la cirugía), tardías (desde siete días hasta 12 semanas desde la cirugía) o complicaciones totales (tempranas y tardías):
-
-
-
cualquier infección posoperatoria;
-
lesiones relacionadas con la cirugía (vasos sanguíneos, nervios, vejiga, intestino);
-
pérdida sanguínea excesiva (según la definición de los estudios);
-
eventos tromboembólicos;
-
cualquier complicación anestésica;
-
otro evento adverso grave;
-
formación de fístulas;
-
disfunción en el vaciamiento o vesical;
-
linfoquistes o linfedema;
-
disfunción psicosexual.
-
-
Complicaciones relacionadas con la quimioterapia y la radioterapia
Los grados de toxicidad quimioterapéutica y radioterapéutica se extrajeron y se agruparon como:
-
hematológicos (leucopenia, anemia, trombocitopenia, neutropenia, hemorragia);
-
gastrointestinales (náuseas, vómitos, anorexia, diarrea, toxicidad hepática, proctitis);
-
genitourinarios;
-
cutáneos (estomatitis, mucositis, alopecia, alergia);
-
neurológicos (periféricos y centrales); y
-
pulmonares.
Results
Description of studies
Results of the search
The search strategy identified 672 unique references. Two review authors (FK, AB) read the abstracts independently and those that did not meet the inclusion criteria were excluded at this stage. Ten articles were retrieved in full and full text screening of these references excluded five of them for the reasons described in the table Characteristics of excluded studies. Seven studies (Benedetti‐Panici 2002; Cetina 2013; Chang 2000; Keys 2003; Morice 2012; Perez 1987; Yamauchi 2010) were identified as having met our inclusion criteria and are described in the table Characteristics of included studies (see PRISMA flow chart for further details of study selection process (Figure 2)).
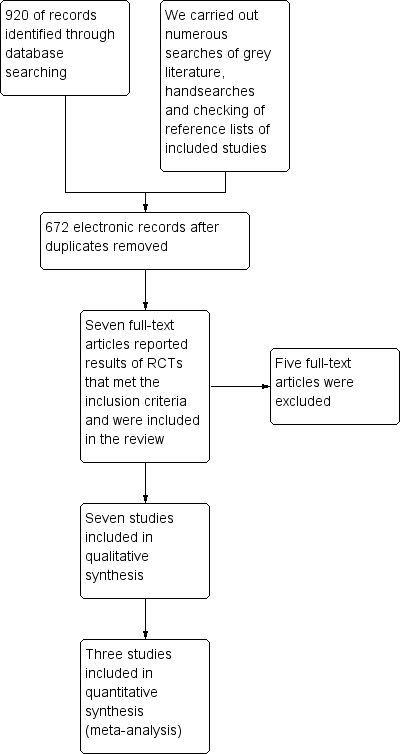
Study flow diagram.
Searches of the grey literature did not identify any additional studies.
Included studies
The seven included studies (Benedetti‐Panici 2002; Cetina 2013; Chang 2000; Keys 2003; Morice 2012; Perez 1987; Yamauchi 2010) randomised a total of 1217 eligible women, all of whom were assessed for primary survival outcomes at the end of the studies.
The review identified the following treatment comparisons for the seven included studies:
-
hysterectomy (simple or radical) with radiotherapy versus radiotherapy alone (Keys 2003; Perez 1987);
-
hysterectomy (simple or radical) with chemoradiotherapy versus chemoradiotherapy alone (Morice 2012);
-
hysterectomy (radical) with chemoradiotherapy versus internal radiotherapy (brachytherapy) with chemoradiotherapy (Cetina 2013);
-
hysterectomy (simple or radical) with neoadjuvant chemotherapy versus radiotherapy alone (Benedetti‐Panici 2002; Chang 2000; Yamauchi 2010).
The duration of follow‐up of participants varied from 36 months to 72 months, in Keys 2003 study those who were last seen alive had a median follow‐up time of 9.6 years (range 0.3 to 16.1).
Trials comparing preoperative radiotherapy and hysterectomy (simple or radical) versus radiotherapy alone
Two studies (Keys 2003; Perez 1987), which included a total of 374 women, compared preoperative radiotherapy and radical hysterectomy versus radiotherapy alone. Keys 2003 included 256 eligible women with stage IB2 disease (tumour size 4 to 8 cm); Perez 1987 included 118 women with stage IIA disease as well as stage IB (but women with a tumour more than 5 cm were excluded). Ths age distribution was comparable in the two groups in both trials, but additional information was not reported in the trial of Perez 1987. In the Keys 2003 trial just over three quarters of the women were 50 years old or under. The majority of women in both trials had squamous cell carcinoma of the cervix. Additional baseline information was not reported in the Perez 1987 trial; but the performance status of women in Keys 2003 was generally good (more than 76% and more than 20% in both arms with performance status of 0 and 1, respectively). Keys 2003 did not mention whether the participants were evaluated clinically or radiologically after radiotherapy in order to assess the tumour response and residual disease.
In the Keys 2003 study, daily fraction size was to be prescribed as 180 Gy and external treatment carried to a total dose of 40 Gy and 45 Gy for the radiation‐only and the adjuvant hysterectomy regimens, respectively. Both groups were to have brachytherapy one to two weeks after completing external treatment. The brachytherapy dose prescription was different between the treatment arms; the radiation‐only group was to receive a dose of 40 Gy with a total dose of 80 Gy to 'point A', while those who were to have a hysterectomy received only 30 Gy with a total dose of 75 Gy to point A. A minimum dose of 55 Gy was prescribed to point B for both regimens. All irradiation was to be completed within 10 weeks. The surgical group in the Keys 2003 trial was then to undergo simple hysterectomy with removal of tubes and ovaries, if present, two to six weeks after completion of all irradiation.
In the Perez 1987 trial, participants who were treated with preoperative radiotherapy and surgery received 20 Gy whole pelvis irradiation and one brachytherapy for 5000 to 6000 mgh (approximately 5 to 6 Gy low dose rate given over 6 days), followed 2 to 6 weeks later by a radical hysterectomy and bilateral pelvic lymphadenectomy (up to the bifurcation of the common iliac vessels). The dose to the cervix was about 70 Gy and to the pelvic lymph nodes 30 Gy.
Treatment with irradiation alone in the Perez 1987 trial consisted of 10 to 20 Gy delivered to the whole pelvis and an additional parametrial dose to total of 50 Gy to the external iliac lymph nodes combined with two brachytherapy insertions for a total of approximately 7500 mgh (65 to 70 Gy to point A). The dose to the paracervical tissues was about 85 Gy and to the pelvic lymph nodes 60 Gy.
Keys 2003 assessed overall survival, pelvic‐free survival and the rate of pelvic recurrence. Perez 1987 assessed the five‐year tumour‐free actuarial survival, the sites of failure after therapy and treatment complications.
Trial comparing chemoradiotherapy and hysterectomy (simple or radical) versus chemoradiotherapy alone
One RCT (Morice 2012) included 61 women with FIGO stage IB2 or II cervical cancer with a complete clinical and radiological response after chemoradiotherapy, randomly allocated to the treatment arms: hysterectomy or no hysterectomy. The median age and stage distribution was similar in both groups (45 years in the chemoradiotherapy and hysterectomy arm and 44 years in the chemoradiotherapy and no hysterectomy arm). Half of the women had FIGO stage IB2 and half stage II disease. The majority of participants in each group (more than 80%) had squamous cell cancer. The performance status of the included women was not described.
Radiotherapy was delivered to the pelvis for a total dose of 45 to 50 Gy, in five fractions of 1.8 to 2 Gy per week, followed 1 to 2 weeks later by brachytherapy. Most women in both groups had one application of brachytherapy at a dose of 15 Gy. Concomitant chemoradiotherapy was cisplatin during external radiotherapy. A complete clinical and radiological response (based on magnetic resonance imaging (MRI)) was evaluated six to eight weeks after internal radiotherapy.
Hysterectomy could be performed via laparotomy or a laparoscopy and could be extrafascial or radical (type II according to the Piver classification) according to the preoperative examination. A selective or complete pelvic lymphadenectomy was optional and could be performed if lymphadenopathy was detected during surgery.
The trial gave HRs for overall and recurrence‐free survival as well as reporting the site of first recurrence. Morbidity was not reported after confirmation from the study authors. The median duration of follow‐up was 3.8 years (range 0.4 to 5.8) when the trial was closed early because of poor accrual.
Trial comparing internal radiotherapy after external‐beam radiotherapy with chemotherapy versus radical hysterectomy after external‐beam radiotherapy with chemotherapy
One RCT (Cetina 2013) conducted in Mexico included 211 women aged between 18 and 70 years with a histological diagnosis of untreated FIGO stage IB2 to IIB cervical cancer and no evidence of para‐aortic lymph node involvement. It was reported that these 211 women were randomly allocated to either brachytherapy after external‐beam radiotherapy with chemotherapy or radical hysterectomy after external‐beam radiotherapy with chemotherapy. Women were ineligible for the study if they had previously received chemotherapy or radiotherapy. The median age, and stage distribution, was similar in both groups (44 years in the brachytherapy arm and 45 years in the hysterectomy arm). The median performance status (Karnofsky) score was 90 in both arms and the median tumour size was also the same in the two arms (32 mm). Most participants in each treatment arm had FIGO stage IIB disease (70% and 74% of participants in the brachytherapy and hysterectomy arms, respectively). The majority of participants in each group (more than 80%) had squamous cell cancer.
Participants received 50.4 Gy external‐beam radiotherapy to the entire pelvic region in 28 sessions of 1.8 Gy/day, 5 days/week, over the 6 weeks of chemotherapy.
Immediately after completion of external‐beam radiotherapy with chemotherapy, participants in arm 1 underwent low‐dose rate brachytherapy. A brachytherapy dose of 30 to 35 Gy was delivered to point A, to result in a cumulative dose of 80 to 85 Gy combining external‐beam radiotherapy and brachytherapy. The cumulative external‐beam radiotherapy and brachytherapy dose to point B (the pelvic wall) was 55 to 65 Gy.
Within four to six weeks after the external‐beam radiotherapy with chemotherapy, arm 2 participants were submitted to type III radical hysterectomy and bilateral pelvic lymph node dissection and para‐aortic lymph node sampling, if the multidisciplinary team judged the disease could be resected obtaining margins free of disease. Postoperative low‐dose rate brachytherapy was mandated in the surgical arm participants only if the surgical specimen revealed positive surgical margins and was administered within 4 weeks after surgery at a median dose of 30 Gy to the vaginal mucosa delivered to a depth of 0.5 cm.
The trial gave HRs for overall and progression‐free survival. The trial also reported pathological response, operative complications, toxicity to chemoradiation with cisplatin and gemcitabine, long‐term complications and late complications including proctitis, cystitis and hydronephrosis. Only the latter was reported in a breakdown by treatment arm. The median duration of follow‐up in the trial was 36 months (3 to 80 months).
Trials comparing neoadjuvant chemotherapy and hysterectomy (simple or radical) versus radiotherapy alone
Three RCTs (Benedetti‐Panici 2002; Chang 2000; Yamauchi 2010) that randomised a total of 571 participants compared neoadjuvant chemotherapy and hysterectomy (simple or radical) versus radiotherapy alone. Benedetti‐Panici 2002 included women with stage IB2 to III cervical cancer, Chang 2000 included women with IB to IIA bulky disease, and Yamauchi 2010 had only women with stage IIIB disease. The median age in each arm was similar in Benedetti‐Panici 2002 and Chang 2000 (range 46 to 52), whereas in Yamauchi 2010 women were significantly older in the radiotherapy arm (mean age was 53 in the neoadjuvant chemotherapy and hysterectomy versus 60 years in the radiotherapy arm). All the women in Benedetti‐Panici 2002 and Yamauchi 2010 and the majority in Chang 2000 had squamous cell cancer cancers. In Benedetti‐Panici 2002 and Chang 2000 the Eastern Cooperative Oncology Group performance status was zero for the majority of the eligible women. The performance status was not reported in Yamauchi 2010.
In Benedetti‐Panici 2002 the neoadjuvant chemotherapy regimen was not predetermined; minimal requirements were a cisplatin‐containing regimen with a ≥ 240 mg/m2 total cisplatin dose with a maximum of two additional drugs, administered over a period of 6 to 8 weeks. After neoadjuvant chemotherapy, the women were clinically reassessed and classified as suitable or unsuitable for radical surgery. The latter participants were treated with radiotherapy. Surgery consisted of radical hysterectomy (type III to V) plus systematic (at least 20 nodes to be resected) pelvic lymphadenectomy (aortic lymphadenectomy was optional). Postoperative radiotherapy was given in participants with positive surgical resection margins or metastatic nodes, or both. In the case of node metastasis, the choice of adjuvant treatment was based on the institution’s policy (for example chemotherapy, external‐beam radiotherapy, or no further therapy). Adjuvant treatment was given to 48 participants in the surgical group (29%); 38 (23%) participants in the surgical group underwent adjuvant radiotherapy.
Conventional radiotherapy consisted of external‐beam, megavoltage radiotherapy (45 to 50 Gy) to the whole pelvis over five to six weeks. In the presence of metastatic pelvic nodes an extra dose of 5 to 7 Gy was administered. Low‐dose rate brachytherapy (20 to 30 Gy to the tumour volume) was provided two to four weeks after external radiotherapy. Aortic node metastases, when present, were irradiated (45 Gy/5 weeks, followed by a 5 Gy boost if residual disease was eventually detected) with extended fields encompassing pelvic and aortic volume or at the end of pelvic irradiation, in the case of a pelvic complete remission. Salvage treatments were allowed in women who showed progressive disease.
In Chang 2000 the neoadjuvant chemotherapy was cisplatin and vincristine, followed by bleomycin. Two to four weeks after the completion of neoadjuvant chemotherapy participants underwent a type III radical abdominal hysterectomy and pelvic lymphadenectomy. The adnexae were usually left in women ≤ 40 years old if they were gross appearance was normal.
The radiotherapy usually included a combination of external radiotherapy and high‐dose rate brachytherapy; with 40 to 44 Gy whole pelvic irradiation. The para‐aortic lymph nodes were not routinely included in the treatment field. Parametria received up to 50 Gy. If bulky tumour persisted after 44 Gy of irradiation, external‐beam doses to the lower pelvis were increased to 50 to 54 Gy without central block followed by brachytherapy, or to 70 Gy without internal radiotherapy. The median cumulative dose to point A in this treatment protocol was 70 Gy. Thirty‐seven participants were treated using this method. The postoperative radiotherapy was given by using techniques similar to those described above. The dose to the whole pelvis was 44 to 45 Gy, and that to the true pelvis was 50 to 54 Gy. After external radiotherapy, brachytherapy was given in two to three fractions with a total dose of 4 to 6 Gy/0.5 cm below the vaginal mucosa.
Participants in the neoadjuvant chemotherapy arm had a higher incidence of receiving adjuvant therapy with either radiotherapy or chemotherapy after the scheduled treatment than those in the radiotherapy arm, who received radical hysterectomy as the adjuvant therapy. Of the 68 women in the neoadjuvant chemotherapy arm 62 underwent hysterectomy and 19 of those had adjuvant radiotherapy, six had adjuvant chemotherapy and two had combined chemotherapy and radiotherapy.
In Yamauchi 2010 the neoadjuvant chemotherapy regimen consisted of cisplatin, bleomycin and mitomycin for three courses every four weeks. If the tumour was surgically removable, a radical hysterectomy was performed with bilateral salpingo‐oophorectomy and pelvic lymphadenectomy, and then radiotherapy was given at 40 Gy to the whole pelvic region. If the tumour progressed or relapsed, combined chemotherapy of bleomycin, vincristine, mitomycin and cisplatin (BOPM) was given, and then irinotecan with cisplatin as the third line. If the local tumour was inoperable (N = 1), radiotherapy was given at 40 Gy to the whole pelvic region with 20 Gy brachytherapy, followed by BOPM chemotherapy.
The radiotherapy group received radiotherapy to the whole pelvic region in 20 fractions total ling 40 Gy. The total dose delivered to point B as a boost dose with midline shield coverage was 20 Gy. The total dose delivered by brachytherapy was 24 to 30 Gy. The pelvic field extended from the upper margin of L5 to the mid‐portion of the obturator foramen or the lowest level of disease, with a 3 cm margin, and laterally 1.5 to 2 cm beyond the lateral margins of the bony pelvic wall. The duration of the radiotherapy was four weeks. In cases with local recurrence or progression of the primary lesion, chemotherapy was added, which included BOMP, irinotecan with cisplatin, and cisplatin or carboplatin alone. When distant metastasis occurred, the researchers added radiotherapy, or the single lesion was surgically removed.
All three studies assessed overall survival, and additionally progression‐free survival in Benedetti‐Panici 2002 and disease‐free survival in the other two studies (Chang 2000; Yamauchi 2010). However, the definition of disease‐free survival in Chang 2000 was absence of persistent or recurrent disease, so this appeared to be a combination of progression and disease‐free survival. It was possible to include all three studies in a meta‐analyses of overall survival and progression or disease‐free survival as HR estimates were either explicitly reported, deduced (Parmar 1998) or obtained via personal correspondence (Yamauchi 2010). Benedetti‐Panici 2002 reported severe toxicity and complications and Chang 2000 reported tumour response to treatment and toxicity. Yamauchi 2010 did not report adverse events and none of the three studies reported on quality of life outcomes.
Excluded studies
Out of the 12 references that were retrieved in full text, five were excluded for the following reasons.
-
Four studies (Katsamuta 2013; Keys 1999; Sardi 1997; Sun 2013) included women who received hysterectomy or surgical staging in both arms.
-
Sundfor 1996 compared surgery versus radiotherapy in women with early stage carcinoma of the cervix.
For further details of the excluded studies see the table Characteristics of excluded studies.
Risk of bias in included studies
Five studies (Benedetti‐Panici 2002; Cetina 2013; Chang 2000; Keys 2003; Morice 2012; Perez 1987; Yamauchi 2010) were at high risk of bias, and Benedetti‐Panici 2002 (which satisfied four of the criteria that we used to assess risk of bias) and Chang 2000 (which satisfied three items) appeared to be at moderate to high risk of bias (see Figure 1).
Allocation
Only Keys 2003 and Perez 1987 reported the method of generation of the sequence of random numbers used to allocate women to the treatment arms, but they did not report concealment of this allocation sequence from participants and the healthcare professionals involved in the trials. The other five trials did not report on the method of sequence generation, although two trials (Benedetti‐Panici 2002; Chang 2000) reported adequate concealment of allocation. Allocation concealment was unclear in five trials (Cetina 2013; Keys 2003; Morice 2012; Perez 1987; Yamauchi 2010).
Blinding
Since it was not possible to blind participants and clinicians to these particular interventions, performance bias may have been an issue in all seven included trials. Blinding of the outcome assessors was not reported in any of the trials with the exemption of Benedetti‐Panici 2002, which reported adequate blinding, so the other six trials may have been prone to detection bias.
Incomplete outcome data
At least 80% of eligible women who were randomised were assessed at the endpoint in all seven trials. Intention‐to‐treat analyses were used in the Benedetti‐Panici 2002, Cetina 2013, Keys 2003 and Yamauchi 2010 trials. In the Chang 2000 trial, intention‐to‐treat analysis was carried out for survival outcomes. Intention‐to‐treat analyses were not used in the Perez 1987 and Morice 2012 trials.
Selective reporting
The authors of four studies (Benedetti‐Panici 2002; Cetina 2013; Chang 2000; Keys 2003) reported pertinent outcomes, although none reported quality of life outcomes. Adverse events or toxicity were not reported in two studies (Morice 2012; Yamauchi 2010) and overall survival was not reported in Perez 1987, despite the fact that the number of women who had died would have been known since disease progression was defined as the number of women whose disease had progressed or died. This raised concern about a significant reporting bias.
Other potential sources of bias
It was unclear whether any additional forms of bias may have been present in six studies so this item was scored as being at unclear risk of bias, although over a quarter of participants in each arm deviated from the protocol in Benedetti‐Panici 2002 and so this study was at high risk of bias for this item.
Effects of interventions
See: Summary of findings for the main comparison
Preoperative radiotherapy and hysterectomy (simple or radical) versus radiotherapy alone
Keys 2003 and Perez 1987 included a total of 374 women and compared preoperative radiotherapy and radical hysterectomy versus radiotherapy alone. The trialists gave a breakdown by FIGO stage and intervention group in Perez 1987 but did not report overall survival or use appropriate survival techniques to allow the trial to be pooled.
Overall survival
In Keys 2003 there was no difference in the risk of death between women who received radiotherapy followed by extrafascial hysterectomy and those who received radiotherapy alone (HR 0.89, 95% CI 0.61 to 1.29, low quality evidence).
Progression‐free survival
In Keys 2003 there was no difference in the risk of disease progression or death between women who received radiotherapy followed by hysterectomy and those who received radiotherapy alone (HR 0.77, 95% CI 0.54 to 1.10, low quality evidence).
Tumour‐free actuarial survival at five years
In Perez 1987 5‐year, tumour‐free actuarial survival for women with stage IB was 80% in the preoperative radiotherapy and surgery group and 89% with radiotherapy alone. It was not reported how many women were stage IB1 and how many stage IB2 (the latter group was the group of interest for this Cochrane review). Women with barrel‐shaped cervix (endocervical lesion with cervix diameter larger than 5 cm) were excluded. In stage IIA, the 5‐year tumour‐free survival was 79% in the preoperative radiotherapy and surgery group and 56% in the radiotherapy alone group. These differences were not statistically significant (low quality evidence).
Severe complications and adverse effects
In the women with stage IB disease in Perez 1987, only 1/48 (2%) of women experienced a severe complication (grade 3) in the radiotherapy and surgery group (ureteral stricture) whereas 5/40 experienced severe complications in the radiotherapy alone group (including rectovaginal fistula, vesicovaginal fistula, ureteral stricture and pelvic infection). This difference was not statistically significant. Similarly in women with stage IIA disease, 5/14 (40%) women experienced a severe complication in the radiotherapy and surgery group (including proctitis, rectal stricture, small bowel stricture and ureteral stricture) whereas only 1/16 experienced a severe complication in the radiotherapy alone group (rectal stricture). This difference was not statistically significant (low quality evidence).
In Keys 2003 it was stated that both treatment programs were well tolerated and there did not appear to be a difference between the two groups in terms of adverse effects. There were 18/129 women with a grade 3 or 4 adverse effect in the hysterectomy and radiotherapy group and 19 cases in 18/121 women of severe adverse effects in the radiotherapy alone group. Two women in each group received no radiotherapy and were not included (low quality evidence).
Chemoradiotherapy and hysterectomy (simple or radical) versus chemoradiotherapy alone
Morice 2012 included 61 women and compared chemoradiotherapy and simple or radical hysterectomy versus chemoradiotherapy alone.
Overall survival at three years
There was no difference in the 3‐year event‐free (death) survival rate (86% and 97% in the chemoradiotherapy plus hysterectomy and chemoradiotherapy alone groups, respectively; log rank P value = 0.15, low quality evidence).
Recurrence‐free survival at three years
There was no difference in the 3‐year event‐free (recurrence) survival rate (72% and 89% in the chemoradiotherapy plus hysterectomy and chemoradiotherapy alone groups, respectively; log rank P value = 0.17, low quality evidence).
The authors reported that morbidity was studied in a further publication, but when we contacted them they could not provide data on morbidity.
Brachytherapy after external‐beam radiotherapy with chemotherapy versus radical hysterectomy after external‐beam radiotherapy with chemotherapy
Cetina 2013 included 211 women and compared brachytherapy versus radical hysterectomy in women who had already received external‐beam chemoradiotherapy with gemcitabine plus cisplatin.
Overall survival
There was no difference in the risk of death between women in the brachytherapy group and those in the radical hysterectomy group (HR 0.65, 95% CI 0.35 to 1.21, P value = 0.19, low quality evidence).
Progression‐free survival
There was no difference in the risk of disease progression or death between women in the brachytherapy group and those in the radical hysterectomy group (HR 0.70, 95% CI 0.31 to 1.34, P value = 0.24, low quality evidence).
Severe late complications
There was no difference in the proportion of women with severe late complications in the brachytherapy and radical hysterectomy groups (P value = 0.53, low quality evidence). There were four cases of grade 3 or 4 proctitis in the brachytherapy group and two cases in the radical hysterectomy group. There were three cases of severe cystitis in the internal radiotherapy group and none in the radical hysterectomy group, and there were no reported cases of grade 3 or 4 hydronephrosis in either group.
Of the 211 participants in the trial chemoradiotherapy with cisplatin and gemcitabine appeared to be reasonably well tolerated, although nearly a third of women experienced severe neutropenia (grade 3 in the majority). Of the 86 women who received a radical hysterectomy, the number of intraoperative and early surgical complications appeared to be reasonably low, with bleeding (9/86) being the most common.
Neoadjuvant chemotherapy and hysterectomy (simple or radical) versus radiotherapy alone
Overall survival
Meta‐analysis of three studies (Benedetti‐Panici 2002; Chang 2000; Yamauchi 2010), assessing 571 participants, found that women who received neoadjuvant chemotherapy plus hysterectomy had a lower risk of death compared with those women who received radiotherapy alone (HR 0.71, 95% CI 0.55 to 0.93, moderate quality evidence, see Analysis 1.1).The percentage of the variability in effect estimates that was due to heterogeneity rather than sampling error (chance) was not important (I2= 0%).
Progression and disease‐free survival
Meta‐analysis of three studies (Benedetti‐Panici 2002; Chang 2000; Yamauchi 2010), assessing 571 participants, found no difference in the risk of disease progression between women who received neoadjuvant chemotherapy plus hysterectomy and those who received radiotherapy alone (HR 0.75, 95% CI 0.53 to 1.05, moderate quality evidence, see Analysis 1.2). The percentage of the variability in effect estimates that was due to heterogeneity rather than chance might not have been important (I2 = 20%).
Severe adverse events and toxicity
Acute toxicity
Benedetti‐Panici 2002 reported short‐term complications but it was not possible to make comparisons because participants were compared in terms of those who received neoadjuvant chemotherapy, hysterectomy and radiotherapy separately, and participants may have experienced more than one toxicity in each category (low quality evidence).
Chang 2000 reported 9/68 (13%) cases of grade 3 acute toxicity in the neoadjuvant chemotherapy plus hysterectomy group and 7/50 (22%) cases of severe acute toxicity (5/7 were grade 3) in the radiotherapy alone group. This difference was not significant (RR 1.32, 95% CI 0.47 to 3.71, low quality evidence). Acute toxicities reported in the trial included nausea, vomiting, diarrhoea, liver and dermatological adverse effects.
Long‐term complications and toxicity
In Benedetti‐Panici 2002 long‐term severe complications occurred in 32 (19.5%) women in the neoadjuvant chemotherapy arm and late severe morbidity with radiotherapy was observed in 39 (22%) women. There was no difference in long‐term severe complications between neoadjuvant chemotherapy plus hysterectomy and radiotherapy alone (RR 0.86, 95% CI 0.49 to 1.50, low quality evidence).
Chang 2000 reported 9/68 (13%) cases of severe late toxicity (8/9 were grade 3) in the neoadjuvant chemotherapy plus hysterectomy group and 11/50 (22%) grade 3 cases in the radiotherapy alone group. This difference was not significant (RR 0.60, 95% CI 0.27 to 1.34, low quality evidence). Late toxicities reported in the trial included intestinal obstruction, radiation cystitis, radiation proctitis and lower leg oedema.
Quality of life outcomes were not reported in any of the trials.
Discusión
Resumen de los resultados principales
Se encontraron siete estudios que cumplieron los criterios de inclusión. Estos estudios evaluaron la función de la histerectomía (radical o simple) en combinación con quimioterapia o radioterapia, o ambas, en el tratamiento del cáncer de cuello de útero localmente avanzado. Los siete ensayos incluyeron un total de 1217 mujeres.
Los ensayos controlados aleatorios (ECA) eran de calidad metodológica variable; la mayoría de los ensayos presentaban alto riesgo de sesgo. Estos ensayos compararon los siguientes tratamientos en pacientes con cáncer de cuello de útero localmente avanzado (IB2 a III):
-
histerectomía (simple o radical) con radioterapia versus radioterapia sola(Keys 2003; Perez 1987);
-
histerectomía (simple o radical) con quimiorradioterapia versus quimiorradioterapia sola (Morice 2012)
-
histerectomía (radical) con quimiorradioterapia versus radioterapia interna (braquiterapia) con quimiorradioterapia(Cetina 2013);
-
histerectomía (simple o radical) con quimioterapia neoadyuvante versus radioterapia sola(Benedetti‐Panici 2002; Chang 2000; Yamauchi 2010).
Keys 2003 y Perez 1987 incluyeron 374 mujeres y compararon radioterapia preoperatoria e histerectomía versus radioterapia sola. Estos dos ensayos no informaron diferencias en el riesgo de muerte o progresión de la enfermedad, supervivencia actuarial sin tumor a los cinco años y complicaciones graves entre las pacientes que recibieron radioterapia seguida de histerectomía y las que recibieron radioterapia sola.
Morice 2012 incluyó 61 pacientes y no informó diferencias en la supervivencia general y sin recidiva a los tres años entre quimiorradioterapia e histerectomía (simple o radical) versus quimiorradioterapia sola. No se informaron los eventos adversos y la morbilidad.
Del mismo modo, Cetina 2013 comparó braquiterapia versus histerectomía radical en 211 mujeres que ya habían recibido quimiorradioterapia con gemcitabina más cisplatino. No encontró diferencias en el riesgo de muerte, progresión de la enfermedad o complicaciones graves tardías entre las pacientes del grupo de braquiterapia y las del grupo de histerectomía.
El metanálisis de tres estudios (Benedetti‐Panici 2002; Chang 2000; Yamauchi 2010), que evaluó 571 pacientes, encontró que las pacientes que recibieron quimioterapia neoadyuvante más histerectomía tuvieron menos riesgo de muerte que las que recibieron radioterapia sola, pero no hubo diferencias en la proporción de pacientes con progresión de la enfermedad o recidiva entre los dos grupos.
Benedetti‐Panici 2002 no informó diferencias en las complicaciones graves a largo plazo entre quimioterapia neoadyuvante más histerectomía y radioterapia sola. Además, es necesario considerar que 38 (23%) de las pacientes que se operaron también recibieron radioterapia coadyuvante y que es probable que el 30% de estas pacientes presentaran complicaciones graves tardías.
Chang 2000 no encontró diferencias en la toxicidad aguda grado 3 y la toxicidad grave tardía entre el grupo de quimioterapia neoadyuvante más histerectomía y el grupo de radioterapia sola.
En resumen, estos datos demuestran un posible efecto beneficioso de quimioterapia neoadyuvante más histerectomía versus radioterapia en cuanto a la supervivencia, pero sin diferencias en la supervivencia libre de enfermedad. Esta diferencia se puede deber a la quimioterapia neoadyuvante, al tratamiento coadyuvante o ambos, en lugar de a la histerectomía, ya que estos aspectos también difirieron entre los dos grupos.
Los efectos perjudiciales del tratamiento, especialmente en cuanto a los datos de calidad de vida, se informaron de manera deficiente. Los estudios que compararon el tratamiento estándar más moderno de quimiorradioterapia no demostraron un efecto beneficioso con el agregado de la histerectomía.
Compleción y aplicabilidad general de las pruebas
Los siete estudios incluidos son relevantes en cuanto a la población de pacientes, los tipos de intervenciones, la efectividad y los resultados. Sin embargo, en cuatro estudios (excluyendo los ensayos Cetina 2013, Morice 2012 yKeys 2003) la función de la histerectomía como tratamiento coadyuvante es más difícil de evaluar porque las pacientes que recibieron diferentes tipos de tratamiento primario o neoadyuvante se compararon con el grupo al que se le realizó histerectomía. Tres ensayos(Benedetti‐Panici 2002; Chang 2000; Yamauchi 2010) que compararon quimioterapia neoadyuvante e histerectomía versus radioterapia sola parecieron tener validez externa y representaron una extensa zona geográfica que incluyó Italia, China y Japón. Benedetti‐Panici 2002fue un ensayo multicéntrico. La generalización de otros estudios es menos fuerte ya que las comparaciones difieren entre los estudios y solamente se pudieron informar los resultados de estudios únicos, aunque algunos fueron en centros múltiples, lo que fortalece su representatividad.
Morice 2012 incluyó pacientes que tuvieron una respuesta completa después de la quimiorradioterapia. En el resto de los estudios no se proporcionó una evaluación de la respuesta antes de la cirugía. Es importante señalar que las pacientes con una respuesta completa al tratamiento antes de la cirugía tienen potencialmente un mejor pronóstico en comparación con las pacientes con enfermedad residual, por lo que la función de la histerectomía coadyuvante se debe evaluar en subgrupos con factores pronósticos similares (Gadducci 2013; Landoni 2013; Touboul 2010).
En general, los estudios informaron bien los datos de supervivencia, aunque los datos sobre los efectos perjudiciales se informaron de forma deficiente. Estos datos no son suficientes para recomendar, fuera de ensayos clínicos, agregar la histerectomía a la quimiorradioterapia en las pacientes con cáncer de cuello de útero localmente avanzado.
Las pruebas parecieron ser de calidad baja o muy baja (GRADE Working Group 2004) para todos los resultados de comparación que no fueron quimioterapia neoadyuvante e histerectomía radical versus radioterapia sola. La calidad de las pruebas de la supervivencia general y la supervivencia libre de progresión o libre de enfermedad fue moderada y se disminuyó principalmente debido a inquietudes con respecto al riesgo de sesgo en los ensayos individuales. Los ensayos en todas las comparaciones tienen riesgo alto o moderado de sesgo. Más ensayos que evalúen el tratamiento médico idéntico con y sin histerectomía pueden probar la solidez de los resultados de esta revisión, ya que es probable que estudios de investigación adicionales tengan una marcada repercusión sobre la confianza en las estimaciones del efecto. Los metanálisis en la revisión encontraron que las pacientes que recibieron quimioterapia neoadyuvante más histerectomía tuvieron menos riesgo de muerte que las que recibieron radioterapia sola (CRI 0,71; IC del 95%: 0,55 a 0,93, ver Análisis 1.1), pero no hubo diferencias en la progresión de la enfermedad. Sin embargo, es difícil evaluar la repercusión de la histerectomía realizada en combinación con quimioterapia neoadyuvante, ya que una gran parte de esta diferencia se puede deber al componente de la quimioterapia que controla la enfermedad microscópica distante en lugar de mejorar el control local. Mediante el enfoque GRADE (GRADE Working Group 2004), las pruebas resumidas por esta revisión no son suficientes para hacer cambios en la práctica clínica. La incertidumbre acerca de los efectos adicionales de la histerectomía en varios resultados diferentes justifica su evaluación como agregado de la quimiorradioterapia en los ensayos clínicos futuros.
Calidad de la evidencia
Se revisaron siete estudios heterogéneos con 1217 pacientes que evaluaron la función de la histerectomía con radioterapia o quimioterapia, o ambas, en pacientes con cáncer de cuello de útero localmente avanzado. Las pérdidas durante el seguimiento fueron pequeñas, pero generalmente los ensayos se calificaron de forma deficiente para otros ítems de riesgo de sesgo y tuvieron potencialmente alto riesgo de sesgo. El número de mujeres en los ensayos varió considerablemente, siendo el más amplio (Benedetti‐Panici 2002)con 409 mujeres y el más pequeño (Yamauchi 2010),sólo con 42 mujeres.
Se incluyeron ensayos de cáncer de cuello de útero localmente avanzado, pero estos ensayos tuvieron un número diferente de casos para cada estadio de la enfermedad (estadio IB2 a estadio IIIB), por lo que los resultados pueden haber diferido entre los ensayos.
El tipo y la dosis de tratamiento médico (quimioterapia, radioterapia o ambas) fueron heterogéneos entre los ensayos.
Los indicadores iniciales para medir la salud general de las participantes en los estudios no se informaron completamente. El estado funcional de las pacientes solamente se mencionó en cuatro estudios (Benedetti‐Panici 2002; Cetina 2013; Chang 2000; Keys 1999) y detalles clínicos importantes como el tamaño del tumor y la información sobre la enfermedad residual no se informaron en todos los estudios.
En su mayoría, los resultados primarios de supervivencia se informaron bien. Los CRI se informaron explícitamente, se dedujeron o se obtuvieron mediante correspondencia, por lo que los datos del tiempo hasta el evento se analizaron mediante métodos de supervivencia apropiados en los metanálisis o, cuando fue posible, en informes de estudios únicos. Los efectos perjudiciales no se informaron completamente y la calidad de vida no se informó en los estudios. La morbilidad en el brazo de tratamiento se informó en cinco estudios (Benedetti‐Panici 2002; Cetina 2013; Chang 2000; Keys 2003; Perez 1987), pero no se informó en Morice 2012 y Yamauchi 2010. Es importante describir los efectos secundarios de la histerectomía coadyuvante en las pacientes con cáncer de cuello de útero localmente avanzado que recibieron tratamientos múltiples ya que la bibliografía disponible indica morbilidad grave (Touboul 2010).
En Benedetti‐Panici 2002 el 28% de las pacientes se desvió del protocolo en cada brazo (58 de 210 en el brazo de quimioterapia neoadyuvante e histerectomía, 55 de 199 en el brazo de radioterapia), que es una cifra alta. Una inquietud adicional es que de las 210 pacientes en el brazo de quimioterapia neoadyuvante e histerectomía 75 recibieron radioterapia, 37 debido a que no eran apropiadas para histerectomía y 38 después de la histerectomía. Solamente al 78% (164 de 210) del brazo de quimioterapia neoadyuvante e histerectomía se le realizó cirugía. Este cruzamiento y las desviaciones del protocolo son posibles fuentes de sesgo muy significativas.
Cuatro estudios(Benedetti‐Panici 2002; Cetina 2013; Chang 2000; Keys 2003) no mencionaron la vía de la histerectomía, es decir abierta o laparoscópica. Morice 2012 indicó cuántos casos recibieron procedimientos laparoscópicos o abiertos; sin embargo, los resultados del estudio, incluida la morbilidad, no se subagruparon con respecto a este factor. Las pruebas indican que los procedimientos laparoscópicos pueden tener menos morbilidad que los procedimientos abiertos cuando se realizan en el grupo apropiado de pacientes (Bijen 2009; Colombo 2009; Park 2013). Idealmente, los estudios futuros deben considerar este factor.
En Keys 2003 el estadiaje quirúrgico de los ganglios linfáticos fue opcional y se realizó en 57 pacientes (22%), divididas por igual entre los dos brazos de estudio. Cualquier paciente con metástasis en los nódulos paraaórticos no fue elegible para el ECA. De las 103 pacientes sin estadiaje quirúrgico previo a la asignación al azar, a 54 (52%) se le realizó histerectomía y procedimiento de muestreo de ganglios linfáticos. De estas pacientes, siete (13%) presentaron nódulos paraaórticos positivos. Debido a que el estadiaje quirúrgico de los ganglios linfáticos fue opcional y se realizó en un subgrupo de pacientes, es probable que este estudio estuviera sesgado incluso con respecto a la homogeneidad del estadiaje y el pronóstico de las pacientes incluidas.
En el ensayo Chang 2000 hubo tres rangos diferentes de dosis para la braquiterapia durante el período de estudio.
Esta revisión identificó que se necesitan más pruebas y se justifica evaluar la función de la histerectomía en combinación con otras opciones de tratamiento coadyuvante y neoadyuvante en ensayos clínicos.
La calidad general de las pruebas de quimioterapia neoadyuvante e histerectomía radical versus radioterapia sola es moderada para los resultados de supervivencia y baja para los eventos adversos. Todas las otras comparaciones proporcionaron pruebas de calidad baja, principalmente debido al informe deficiente de los resultados y los datos escasos cuando los resultados se basaron en ensayos individuales. La falta de precisión en los ensayos individuales se puede deber a que no hay diferencias significativas entre los dos tratamientos o a la falta de pruebas, que puede hacerse evidente con un mayor poder estadístico. La calidad de vida no se informó en los ensayos y los eventos adversos no se informaron completamente, de manera que la calidad de las pruebas fue baja o muy baja para estos resultados en todas las comparaciones. Los ensayos en todas las comparaciones presentaban un riesgo alto o moderado de sesgo. Es probable que estudios de investigación adicionales tengan una marcada repercusión sobre la confianza en las estimaciones del efecto y puedan cambiar las estimaciones en las comparaciones de los tratamientos basadas en resultados de ensayos únicos y en resultados que no se informaron completamente; pero existe bastante seguridad en la confiabilidad del metanálisis de quimioterapia neoadyuvante e histerectomía versus radioterapia sola (n = 571) para la evaluación de los resultados de supervivencia.
Sesgos potenciales en el proceso de revisión
Se realizó una búsqueda exhaustiva, incluyendo bases de datos electrónicas y literatura gris. Se evaluaron todas las referencias y dos autores de la revisión extrajeron los datos trabajando de forma independiente. Los estudios incluidos se limitaron a ECA, porque proporcionan el nivel más sólido de pruebas disponibles. En consecuencia, se intentó reducir el sesgo en el proceso de revisión.
Una amenaza significativa para la validez de la revisión es la posibilidad de sesgo de publicación, es decir, que pueden no haberse publicado estudios con resultados negativos que no encontraron que el tratamiento haya sido efectivo. No fue posible evaluar esta posibilidad ya que los metanálisis incluyeron solo tres estudios y la revisión siete estudios en total.
Acuerdos y desacuerdos con otros estudios o revisiones
El tratamiento del cáncer de cuello de útero localmente avanzado se debe individualizar y limitar al menor número posible de formas de tratamiento para lograr la mejor curación con complicaciones mínimas. La alerta del National Cancer Institute de los EE.UU. en febrero de 1999 señaló que la quimiorradioterapia se debe considerar en todas las pacientes con cáncer de cuello de útero. Esta recomendación se basó en las mejorías significativas en la supervivencia general y la supervivencia libre de progresión cuando se administró quimioterapia con cisplatino durante la radiación para varios estadios de cáncer de cuello de útero (Morris 1999; NCI 1999; Rose 1999; Whitney 1999).
La quimiorradioterapia es considerada por muchos grupos (Norteamérica, Europa) como el tratamiento estándar para el cáncer de cuello de útero localmente avanzado(CCMAC 2010; Green 2001). Incluye radioterapia pelviana de haz externo con quimioterapia concomitante con platino, seguida de braquiterapia para potenciar la respuesta central a la enfermedad. Alternativamente, el cáncer de cuello de útero localmente avanzado se ha tratado con radioterapia primaria sola.
En otros países, la falta de acceso a la radioterapia y el presunto control deficiente de la enfermedad metastásica ha requerido la administración de quimioterapia neoadyuvante e histerectomía. La quimioterapia se administra antes que otros tratamientos para reducir el volumen tumoral y, por lo tanto, para hacer a las pacientes con enfermedad clínicamente inoperable susceptibles a la cirugía(Sardi 1990; Sardi 1997).
Más preguntas acerca de la quimioterapia neoadyuvante seguida de histerectomía deben ser respondidas por los hallazgos del ECA de la European Organization for Research and Treatment of Cancer (55994) (EORTC 55994) que compara la quimioterapia neoadyuvante seguida de cirugía con el enfoque de quimiorradioterapia en pacientes con cáncer de cuello de útero localmente avanzado (estadio IB‐II).
Con la histerectomía coadyuvante se extrae el sitio primario del cáncer de cuello de útero. Este enfoque puede ser preferido por las pacientes y los médicos ya que se extrae el "sitio inicial" del tumor. Sin embargo, no hay certeza de que este enfoque dé lugar a una mejoría en la supervivencia. Esta revisión sistemática de ensayos publicados actualmente disponibles no encontró pruebas de que la histerectomía coadyuvante mejore la supervivencia general en las pacientes con cáncer de cuello de útero localmente avanzado tratadas con radioterapia o quimioterapia, o ambas. En las pacientes con una respuesta completa a la quimiorradioterapia o la radioterapia no hay efectos beneficiosos obvios. Las pacientes con una respuesta parcial a la quimiorradioterapia o la radioterapia representan un grupo con pronóstico más deficiente; todavía se debate la función de la histerectomía coadyuvante en este grupo de pacientes (Azria 2005; Houvenaeghel 2007; Ota 2008; Sun 2014; Touboul 2010). En los casos de quimiorradioterapia subóptima, debido a los recursos deficientes para la radioterapia, la histerectomía coadyuvante puede tener una función (Kundargi 2013).
En el ensayo Keys 2003, las pacientes con especímenes de histerectomía francamente positivos progresaron y murieron a una tasa casi siete veces mayor que las pacientes con especímenes negativos. Un estudio retrospectivo (Touboul 2010) evaluó los factores pronósticos y las morbilidades en 150 pacientes con cáncer de cuello de útero localmente avanzado a las que se les realizó cirugía después de quimiorradioterapia. Encontraron que los factores pronósticos más importantes para la supervivencia fueron la presencia y el tamaño de la enfermedad residual y el compromiso ganglionar histológico. Es bien reconocido que hay un riesgo mayor de enfermedad extracervical (diseminación ganglionar o enfermedad distante) en las pacientes con enfermedad residual. Estos autores indicaron que la supervivencia de las pacientes tratadas con quimiorradioterapia para el cáncer de cuello de útero localmente avanzado se podría mejorar potencialmente al mejorar la tasa de respuesta completa en el área irradiada (nódulos del cuello uterino o pelvianos) y al detectar inicialmente las pacientes con diseminación paraaórtica para poder adaptarles el tratamiento. Del mismo modo, Ferrandina 2014 encontró que las pacientes con cáncer de cuello de útero localmente avanzado a las que se les realizó histerectomía coadyuvante después de quimiorradioterapia tuvieron un mayor riesgo de complicaciones posoperatorias si hubo una respuesta subóptima a la quimiorradioterapia y, en menor grado, un estadio más avanzado y linfadenopatía paraaórtica.
Una de las inquietudes con respecto a la cirugía después de la quimiorradioterapia es la morbilidad relacionada con la cirugía. El metanálisis CCMAC 2010 indicó que la quimiorradioterapia por sí misma puede causar efectos secundarios graves; la quimioterapia puede causar toxicidad aguda significativa y la radioterapia puede causar complicaciones tardías que son difíciles de revertir. La cirugía después de estas formas de tratamiento puede ser difícil ya que la calidad de los tejidos y la posibilidad de curación están afectadas negativamente por los tratamientos anteriores. Touboul 2010yFerrandina 2014 encontraron que la morbilidad después de la cirugía fue alta, lo que indica un informe insuficientemente de los datos de morbilidad en los estudios incluidos.
En cinco de los estudios incluidos(Cetina 2013; Keys 2003; Morice 2012; Perez 1987; Yamauchi 2010) no hubo diferencias significativas en la tasa de recidivas locales y distantes entre los dos brazos. En Chang 2000, se observó una reducción en la tasa de recidiva local (9% versus 21%) y una disminución leve en la tasa de recidiva distante (10% versus 13%) en las pacientes que recibieron radiación concurrente y cisplatino e histerectomía radical comparadas con las que recibieron radioterapia sola. La función beneficiosa de la histerectomía en esta diferencia no está clara porque, como se menciona anteriormente, las pruebas indican que es el agregado del cisplatino el que reduce el riesgo de recidiva local y distante (Morris 1999; NCI 1999; Peters 2000 Rose 1999; Whitney 1999).

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Comparison 1 Neoadjuvant chemotherapy and radical hysterectomy versus radiotherapy alone, Outcome 1 Overall survival.
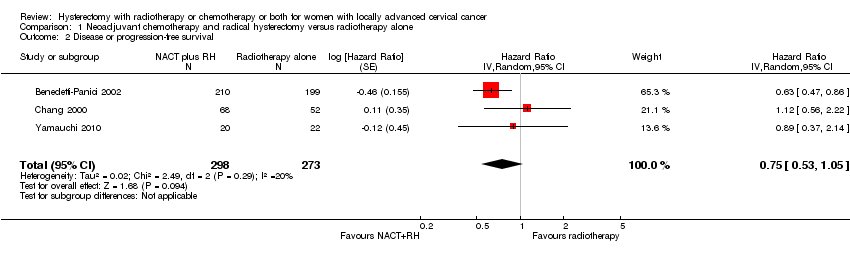
Comparison 1 Neoadjuvant chemotherapy and radical hysterectomy versus radiotherapy alone, Outcome 2 Disease or progression‐free survival.
| Neoadjuvant chemotherapy and radical hysterectomy compared with radiotherapy alone for women with locally advanced cervical cancer | ||||
| Patient or population: Women with locally advanced cervical cancer Settings: Outpatient Intervention: Neoadjuvant chemotherapy and radical hysterectomy Comparison: Radiotherapy alone | ||||
| Outcomes | Relative effect | No of Participants | Quality of the evidence | Comments |
| Overall survival Median follow‐up ranged from 39 to 60 months in the 3 trials | HR 0.71 (0.55 to 0.93) | 571 | ⊕⊕⊕⊝ | Downgraded due to concerns regarding the uncertainty of risk of bias in individual trials |
| Disease or progression‐free survival Median follow‐up ranged from 39 to 60 months in the 3 trials | HR 0.75 (0.53 to 1.05) | 571 | ⊕⊕⊕⊝ | Downgraded due to concerns regarding the uncertainty of risk of bias in individual trials and varying definitions of disease and progression‐free survival. Although we did not feel the latter merited a further downgrade to low quality evidence |
| Severe adverse events and toxicity | Acute severe toxicity: RR 1.32, (0.47 to 3.71) long‐term severe complications: RR 0.86 (0.49 to 1.50) Severe late toxicity: RR 0.60 (0.27 to 1.34) | Acute toxicity 118 (1 RCT) Long‐term severe complications 409 (1 RCT) Severe late toxicity: 118 (1 RCT) | ⊕⊕⊝⊝ | Downgraded due to incomplete and poor reporting of important adverse events and toxicities and sparseness of data |
| GRADE Working Group grades of evidence | ||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Overall survival Show forest plot | 3 | 571 | Hazard Ratio (Random, 95% CI) | 0.71 [0.55, 0.93] |
| 2 Disease or progression‐free survival Show forest plot | 3 | 571 | Hazard Ratio (Random, 95% CI) | 0.75 [0.53, 1.05] |

