Antisepsia de la piel para la reducción de las infecciones relacionadas con el catéter venoso central
Resumen
Antecedentes
El catéter venoso central (CVC) es un dispositivo utilizado para muchas funciones, incluida la monitorización de los indicadores hemodinámicos y la administración de fármacos intravenosos, líquidos, productos sanguíneos y la nutrición parenteral. Sin embargo, debido a que es un objeto extraño, es susceptible a la colonización por microorganismos, que puede dar lugar a la septicemia y a su vez, a un aumento de la mortalidad, la morbilidad y los costos de asistencia sanitaria.
Objetivos
Evaluar los efectos de la antisepsia de la piel como parte de la atención del CVC para la reducción de la septicemia relacionada con el catéter, la colonización del catéter y la mortalidad y la morbilidad del paciente.
Métodos de búsqueda
En mayo 2016 se hicieron búsquedas en: registro especializado del Grupo Cochrane de Heridas (Cochrane Wounds Group); Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials) (CENTRAL) (The Cochrane Library); Ovid MEDLINE (incluyendo In‐Process & Other Non‐Indexed Citations and Epub Ahead of Print); Ovid EMBASE y EBSCO CINAHL Plus. También se realizaron búsquedas de estudios en curso y no publicados en registros de ensayos clínicos. No hubo restricciones con respecto al idioma, la fecha de publicación o el ámbito de estudio.
Criterios de selección
Se incluyeron ensayos controlados aleatorios (ECA) que evaluaron cualquier tipo de agente antiséptico de la piel utilizado solo o en combinación, en comparación con uno o más agentes antisépticos cutáneos diferentes, placebo o ninguna antisepsia de la piel en pacientes con un CVC implantado.
Obtención y análisis de los datos
Dos autores de la revisión, de forma independiente, evaluaron la elegibilidad de los estudios, extrajeron los datos y analizaron el riesgo de sesgo. Los resultados se expresaron en cuanto al cociente de riesgos (CR), la reducción del riesgo absoluto (RRA) y el número necesario a tratar para un resultado beneficioso adicional (NNTB) para los datos dicotómicos, y la diferencia de medias (DM) para los datos continuos, con intervalos de confianza (IC) del 95%.
Resultados principales
Trece estudios reunieron los requisitos para la inclusión, aunque sólo 12 estudios contribuyeron con datos, con un total de 3446 CVC evaluados. El número total de participantes reclutados fue incierto, ya que algunos estudios no proporcionaron esta información. Los participantes fueron principalmente adultos que habían ingresado a unidades de cuidados intensivos, unidades de oncología, de hematología o salas generales. La mayoría de los estudios evaluó la antisepsia de la piel antes de la inserción y regularmente de forma posterior durante el período en el que el CVC permaneció insertado, con una variación de cada 24 h a cada 72 h. La calidad metodológica de los estudios incluidos fue diversa debido a la variación amplia en el riesgo de sesgo. La mayoría de los ensayos no realizó un cegamiento adecuado de los participantes o el personal, y cuatro de los 12 estudios tuvieron un alto riesgo de sesgo para los datos de resultado incompletos.
Tres estudios compararon diferentes regímenes de antisepsia con ninguna antisepsia. No hubo pruebas claras de una diferencia en todos los resultados examinados, incluida la septicemia relacionada con el catéter, la septicemia, la colonización del catéter y el número de pacientes que requirieron antibióticos sistémicos para cualquiera de las tres comparaciones que incluyeron tres regímenes diferentes de antisepsia (povidona yodada acuosa, clorhexidina acuosa y alcohol en comparación con ninguna antisepsia de la piel). Sin embargo, hubo grandes dudas en todos los cálculos debido al poco poder estadístico de los análisis y la calidad general muy baja de las pruebas presentadas. Hubo múltiples comparaciones directas entre los diferentes agentes antisépticos cutáneos, con diferentes combinaciones de sustancias activas y soluciones de base. La comparación más frecuente fue la solución de clorhexidina versus solución de povidona yodada (cualquier base). Hubo pruebas de calidad muy baja (disminuida por el riesgo de sesgo y la imprecisión) de que la clorhexidina puede reducir la septicemia relacionada con el catéter en comparación con la povidona yodada (CR de 0,64; IC del 95%: 0,41 a 0,99; RRA 2,30%, IC del 95%: 0,06 a 3,70%). Estas pruebas provinieron de cuatro estudios que incluían 1436 catéteres. Ninguna de las comparaciones de subgrupos individuales de la clorhexidina acuosa versus povidona yodada acuosa, clorhexidina alcohólica versus povidona yodada acuosa y clorhexidina alcohólica versus povidona yodada alcohólica mostró diferencias claras para la septicemia relacionada con el catéter o la mortalidad (y generalmente tuvieron poco poder estadístico). La mortalidad sólo se informó en un único estudio.
Hubo pruebas de calidad muy baja de que la antisepsia de la piel con clorhexidina también puede reducir la colonización del catéter en relación con la povidona yodada (CR de 0,68; IC del 95%: 0,56 a 0,84; RRA 8%, IC del 95%: 3% a 12%; ; cinco estudios, 1533 catéteres, calidad disminuida por riesgo de sesgo, dificultad para la generalización e inconsistencia).
Las evaluaciones de otros agentes antisépticos cutáneos en general se realizaron en estudios únicos y pequeños, muchos de los cuales no informaron el resultado primario de la septicemia relacionadas con el catéter. Los ensayos también informaron de manera deficiente sobre otros resultados, como las infecciones de la piel y los eventos adversos.
Conclusiones de los autores
No está claro si la limpieza de la piel alrededor de los sitios de inserción del CVC con antiséptico reduce la infección del torrente sanguíneo relacionada con el catéter en comparación con ninguna limpieza de la piel. La limpieza de la piel con solución de clorhexidina puede reducir las tasas de septicemia relacionada con el catéter y de colonización del catéter en comparación con la limpieza con povidona yodada. Estos resultados se basan en pruebas de calidad muy baja, lo cual significa que los efectos verdaderos pueden ser muy diferentes. Además estos resultados pueden ser influenciados por la naturaleza de la solución antiséptica (es decir acuosa o a base de alcohol). Se necesitan ECA adicionales para evaluar la efectividad y la seguridad de diferentes regímenes de antisepsia de la piel en la atención del CVC; los mismos deben medir e informar sobre los resultados clínicos críticos como la sepsis, la septicemia y la mortalidad relacionada con el catéter.
PICOs
Resumen en términos sencillos
Antisepsia de la piel para la reducción de las infecciones relacionadas con el catéter venoso central
Pregunta de la revisión
Se examinaron las pruebas acerca de si el uso de tratamientos con antisépticos en la piel del paciente ayuda a reducir las infecciones relacionadas con los catéteres venosos centrales (CVC).
Antecedentes
Los catéteres venosos centrales (CVC) son tubos delgados y flexibles que se insertan a través de la piel en una vena grande, a menudo en el brazo o el tórax. Luego el tubo puede usarse para administrar líquidos, medicación y nutrición a los pacientes con enfermedades crónicas y graves. Sin embargo, los CVC plantean un riesgo significativo de infección al proporcionar una forma de propagación de los microorganismos (gérmenes) en el cuerpo en el momento en que se inserta el catéter. Con objeto de tratar de reducir las infecciones relacionadas con el catéter, el personal de la asistencia sanitaria usa con frecuencia soluciones antisépticas para limpiar la piel alrededor del sitio de inserción del catéter, tanto antes de la inserción como mientras el catéter está implantado. En esta revisión, se resumieron las pruebas de los efectos beneficiosos y perjudiciales del uso de antisépticos en la piel, y los efectos de diferentes soluciones antisépticas.
Fecha de la búsqueda
Se realizaron búsquedas en múltiples bases de datos médicas en mayo 2016.
Características de los estudios
En mayo de 2016 se efectuaron búsquedas en las bases de datos médicas para encontrar ensayos controlados aleatorios que consideraban el uso de antisépticos en la piel en pacientes con CVC. Se incluyeron 13 estudios en esta revisión, aunque sólo 12 aportaron datos para un total de 3446 CVC. Los participantes del estudio eran sobre todo adultos de las unidades de cuidados intensivos u otras unidades especializadas del hospital. Los resultados se informaron en cuanto al número de catéteres, debido a que algunos estudios no proporcionaron el número de pacientes evaluados, y algunos pacientes tenían más de un CVC. Un estudio fue financiado por un cuerpo de investigación nacional, cinco estudios fueron financiados completamente o en parte por al menos una compañía farmacéutica y en los siete estudios restantes no se establecieron las fuentes de financiamiento.
Resultados clave
Tres estudios examinaron el efecto de la limpieza versus ninguna limpieza, y no encontraron pruebas claras de diferencias en las infecciones sanguíneas, las infecciones en el catéter y la necesidad de antibióticos entre los pacientes que recibieron limpieza en comparación con los que no. La solución de clorhexidina puede reducir las infecciones sanguíneas asociadas con el catéter en comparación con la solución de povidona yodada (con una reducción de la tasa de infección de 64 casos por 1000 pacientes con un CVC con povidona yodada a 41 casos de infección por 1000 con clorhexidina). Estas cifras se traducen en un número necesario a tratar de 44 pacientes para evitar una infección del torrente sanguíneo adicional. La solución de clorhexidina también puede (en comparación con la solución de povidona yodada) reducir la presencia de organismos infecciosos dentro del catéter (con una reducción de 240 catéteres infectados por 1000 pacientes a 189 catéteres infectados por 1000 pacientes). No está claro si la limpieza de la piel con antisépticos influye en las tasas de mortalidad debido a que sólo un estudio informó estos datos y aunque se observaron tasas de mortalidad similares con povidona yodada y clorhexidina, los números pequeños significan que no es posible descartar una diferencia.
Calidad de la evidencia
La calidad general de las pruebas fue deficiente debido a las fallas en la manera en que los estudios estaban diseñados, los tamaños pequeños de los estudios, la inconsistencia de los resultados entre los estudios incluidos y la naturaleza de los resultados informados. Estas fallas han reducido la confianza en los resultados de los estudios. Lo anterior significa que no hay seguridad en cuanto a si la limpieza de la piel alrededor de los sitios de inserción del CVC con antisépticos reduce la infección del torrente sanguíneo relacionada con el catéter y otros efectos perjudiciales, como las infecciones sanguíneas y la mortalidad global en comparación con ninguna limpieza de la piel. La limpieza con solución de clorhexidina puede ser más efectiva que la povidona yodada aunque la calidad de las pruebas fue muy baja.
Conclusiones de los autores
Summary of findings
| Chlorhexidine compared to povidone‐iodine for patients with a central venous catheter | |||||
| Patient or population: patients with a central venous catheter | |||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No. of Participants | Quality of the evidence | |
| Assumed risk | Corresponding risk | ||||
| Povidone‐iodine | Chlorhexidine | ||||
| Catheter‐related BSI ‐ overall comparison between chlorhexidine and povidone‐iodine (during in‐patient stay) | Study population | RR 0.64 | 1436 | ⊕⊝⊝⊝ | |
| 64 per 1000 | 41 per 1000 | ||||
| Moderatea | |||||
| 46 per 1000 | 29 per 1000 | ||||
| Catheter‐related BSI ‐ subgroup: chlorhexidine in aqueous solution versus povidone‐iodine in aqueous solution | Study population | RR 0.64 | 452 | ⊕⊝⊝⊝ | |
| 86 per 1000 | 55 per 1000 | ||||
| Moderate | |||||
| 84 per 1000 | 54 per 1000 | ||||
| Catheter‐related BSI ‐ subgroup: chlorhexidine in alcohol versus povidone‐iodine in aqueous solution | Study population | RR 0.77 | 503 | ⊕⊝⊝⊝ | |
| 70 per 1000 | 54 per 1000 | ||||
| Moderate | |||||
| 69 per 1000 | 53 per 1000 | ||||
| Catheter‐related BSI ‐ subgroup: chlorhexidine in alcohol versus povidone‐iodine in alcohol | Study population | RR 0.4 | 481 | ⊕⊕⊕⊝ | |
| 42 per 1000 | 17 per 1000 | ||||
| Moderate | |||||
| 42 per 1000 | 17 per 1000 | ||||
| Primary BSI or clinical sepsis | No studies under this comparison assessed this outcome. | ||||
| All‐cause mortality ‐ Chlorhexidine in aqueous solution versus povidone‐iodine in aqueous solution | Study population | RR 1.15 | 213 | ⊕⊕⊝⊝ | |
| 236 per 1000 | 271 per 1000 | ||||
| Moderate | |||||
| 236 per 1000 | 271 per 1000 | ||||
| All‐cause mortality ‐ Chlorhexidine in alcohol versus povidone‐iodine in aqueous solution | Study population | RR 0.8 | 222 | ⊕⊕⊝⊝ | |
| 236 per 1000 | 189 per 1000 | ||||
| Moderate | |||||
| 236 per 1000 | 189 per 1000 | ||||
| Mortality attributable the CVC‐related infections. | No studies under this comparison assessed this outcome. | ||||
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence | |||||
| a'Moderate risk' was calculated from the median control event rate for each outcome. | |||||
Antecedentes
Referirse al Apéndice 1 para obtener un glosario de los términos (definiciones según esta revisión solamente).
Descripción de la afección
El concepto del cateterismo venoso central fue introducido por primera vez a principios del último siglo por Bleichroder, Forssmann, Duffy y Authaniac, después de que Bleichroder supuestamente insertara el primer catéter venoso central (CVC) en un ser humano en 1905 (Puri 2009). En las últimas cuatro décadas, el uso de un CVC se ha vuelto importante en el tratamiento de muchos pacientes con enfermedades graves y crónicas. La inserción de un CVC proporciona un acceso vascular seguro para la administración de fármacos intravenosos, líquidos, productos sanguíneos y nutrición parenteral. También sirve como un conducto esencial para el muestreo sanguíneo, la monitorización hemodinámica, el tratamiento de reemplazo renal y la plasmaféresis.
Se calcula anualmente se insertan 5 000 000 de CVC en los Estados Unidos y 200 000 en el Reino Unido (Worthington 2005). Uno de los problemas importantes asociados con el uso de CVC es la colonización por microorganismos que podría dar lugar a infección local o sistémica. La investigación ha indicado que las complicaciones infecciosas asociadas con el CVC causan morbilidad y mortalidad significativa, con considerables costos para el sistema de asistencia sanitaria (CDC 2011; Cicalini 2004). En los EE.UU., cerca de 80 000 casos informados de septicemia asociada al CVC ocurren en las unidades de cuidados intensivos (UCI) cada año; este número alcanza cifras mayores al triple cuando se considera el sistema hospitalario completo (CDC 2011). Aunque se desconoce la mortalidad exacta atribuible a estos casos de septicemia, los informes han citado cifras de hasta un 35% (CDC 2011). El costo asociado debido a los casos de septicemia es considerable, incluidos los costos de la medicación adicional, el tiempo de enfermería y la mayor duración de la estancia hospitalaria. Se calcula que el costo anual total de la atención de los pacientes con septicemia asociada al CVC en los EE.UU. solamente varía de USD 296 000 000 a USD 2 300 000 000 (CDC 2011).
Los microorganismos colonizan los CVC y obtienen acceso al torrente sanguíneo de los pacientes a través de tres rutas principales (CDC 2011; Cicalini 2004; Pagani 2008):
-
La superficie externa del CVC a través del sitio de inserción contaminado
-
La superficie interna del CVC mediante la contaminación del mandril del catéter, los puertos de inyección y las vías; generalmente a través de las manos de los trabajadores sanitarios o los pacientes
-
Fármacos inyectables, infusiones y preparados nutricionales contaminados.
Para los CVC a corto plazo, los investigadores han propuesto la colonización desde la piel a la superficie externa de los CVC como la vía principal de la infección, mientras que para los CVC a largo plazo, la vía de la superficie interna se torna cada vez más importante, debido a que los microorganismos obtienen acceso a la superficie interna como resultado de la contaminación a partir de la manipulación repetida de los CVC (Cicalini 2004).
Descripción de la intervención
Se han formulado varias guías basadas en pruebas en los años recientes dirigidas a reducir la septicemia asociada al CVC. Las medidas importantes recomendadas por dos de las guías principales incluyen las siguientes (CDC 2011; Pratt 2007):
-
Educación del personal
-
Garantía de calidad: monitorización sistemática del cumplimiento de las guías establecidas y evaluación de los temas relacionados al cumplimiento
-
Higiene de las manos
-
Uso de la técnica aséptica durante la inserción y el uso de los CVC
-
Antisepsia efectiva de la piel en el sitio de inserción
-
Máximas precauciones de la barrera estéril (es decir uso de guantes estériles, bata esterilizada, gorro y máscara y uso de un paño esterilizado grande)
-
Uso de la vena subclavia como el sitio preferido de la inserción en lugar de las venas internas yugulares o femorales, debido a que se ha demostrado que lo anterior reduce las complicaciones infecciosas, mecánicas y trombóticas (Hamilton 2007)
-
Uso de CVC impregnados con antimicrobianos o antisépticos.
La antisepsia efectiva de la piel desde el principio hasta el final del período en el que el catéter permanece insertado puede prevenir la contaminación microbiana del sitio de inserción, y así retardar o reducir el riesgo de la colonización del catéter y el desarrollo posterior de complicaciones infectivas. Debido a que la contaminación del sitio de inserción da lugar a la colonización en la superficie externa del catéter y a infección, se esperaría que la antisepsia de la piel tuviese algún impacto sobre la reducción de la septicemia, especialmente con los CVC a corto plazo.
El trabajo pionero de Pasteur, Semmelweis y Lister sentó las bases para la práctica de la antisepsia en la medicina (Bankston 2005; Bynum 2008; Nuland 2003). La antisepsia se define como la prevención de la infección al inhibir el crecimiento de los microorganismos causales, mientras los antisépticos son sustancias antimicrobianas capaces de producir la antisepsia (Taber 2016). Un agente antiséptico ideal necesitaría ser inmediatamente y persistentemente efectivo cuando se lo aplica a los tejidos vivos, incluso cuando hay una cantidad pequeña de sangre presente, y ser efectivo contra todas las bacterias patógenas, los virus, los hongos, los protozoos, los bacilos tuberculosos y las esporas bacterianas (Taber 2016). Al mismo tiempo debe ser no tóxico para el tejido vivo, hipoalergénico y seguro para utilizarlo de forma repetitiva en todas las partes del cuerpo (Edwards 2008; Hardin 1997). La piel humana naturalmente tiene una flora microbiológica abundante que incluye la flora residente (es decir colonizadora) y la flora transitoria (es decir contaminante o no colonizadora). La flora residente tiende a habitar las capas más profundas de la piel y por lo tanto no es eliminada fácilmente por la acción mecánica del lavado con jabón y agua. Por el contrario, la flora transitoria está sistemáticamente presente en la mayoría de las personas y generalmente puede ser eliminada por la acción mecánica (Larson 1995; Ryan 2004). Tanto la flora residente como la transitoria están implicadas en la patogenia de las infecciones asociadas con el CVC, por lo tanto la antisepsia efectiva de la piel puede requerir la eliminación no sólo mecánica sino también química y la inhibición tanto de la flora residente como transitoria de la piel humana (Edwards 2008).
De qué manera podría funcionar la intervención
Hay un gran número de agentes antisépticos disponibles y tres se consideran particularmente importantes en la antisepsia de la piel: la clorhexidina, el yodo y el alcohol. Los tres agentes tienen un espectro de actividad amplio contra las bacterias grampositivas, gramnegativas, aeróbicas y anaerobias, los virus con envoltura como el virus de la inmunodeficiencia humana (VIH), el virus del herpes simple (VHS) y el citomegalovirus (CMV), así como los hongos, aunque difieren en los efectos contra los bacilos tuberculosos y las esporas bacterianas. Aquí se resumen sus características:
-
La clorhexidina, que está disponible principalmente como gluconato de clorhexidina y menos comúnmente como acetato de clorhexidina o clorhidrato (Martindale 2016), ejerce su acción antimicrobiana principalmente al causar una alteración de las membranas de las células microbianas. Su actividad contra los bacilos tuberculosos y las esporas bacterianas es limitada (Larson 1995; Russell 1986). El gluconato de clorhexidina tiene un inicio intermedio del efecto, y se informa que es mínimamente afectado por los materiales orgánicos como la sangre, el pus o el esputo. También parece causar un nivel relativamente bajo de irritación de la piel y tiene poco potencial alergénico. Sin embargo, su actividad es dependiente del pH, y se sabe que su efecto se ve afectado por muchas sustancias, incluidas las utilizadas en los jabones naturales (Larson 1995; Martindale 2016).
-
El yodo y los yodóforos ejercen sus efectos antimicrobianos mediante la destrucción química de la pared de las células microbianas y los contenidos celulares. Son efectivos contra los bacilos tuberculosos y las esporas bacterianas. Eliminan las bacterias en segundos a minutos pero se desactivan rápidamente en presencia de materiales orgánicos como la sangre, el pus o el esputo. Ha habido informes de irritación frecuente de la piel, reacciones alérgicas y toxicidad sistémica en individuos susceptibles (Edwards 2008; Hardin 1997; Larson 1995).
-
Los alcoholes están disponibles como alcohol etilo (etanol), alcohol normal‐propilo (N‐propil) o alcohol isopropílico para su uso como agentes antisépticos. Los alcoholes derivan su actividad antimicrobiana de la desnaturalización de las proteínas celulares. Son efectivos contra los bacilos tuberculosos pero presentan menos efectividad contra las esporas bacterianas. Los alcoholes tienen un inicio rápido de la acción, pero pierden sus efectos antimicrobianos muy rápidamente. Es importante destacar que, para esta revisión, a menudo se combinan con otros agentes como gluconato de clorhexidina o yodo para lograr una antisepsia óptima. Los alcoholes también son agentes de limpieza deficientes, y su uso generalmente no se recomienda cuando se observa la presencia de cantidades significativas de sangre o suciedad. Ha habido informes de un secado excesivo de la piel y malestar posterior a la aplicación (Larson 1995; Martindale 2016).
Otros agentes antisépticos incluyen los siguientes (Larson 1995; Martindale 2016):
-
Triclosán
-
Hexaclorofeno
-
Cloroxilenol
-
Compuestos de amonio cuaternario como la cetrimida y el cloruro de benzalconio
-
Diclorhidrato de octenidina
-
Compuestos de ácidos fenólicos o carboxílicos
-
Peróxido de hidrógeno.
Por qué es importante realizar esta revisión
Un metanálisis indicó que el uso de gluconato de clorhexidina para la atención del sitio del catéter redujo el riesgo de septicemia relacionada con el catéter en un 49% en comparación con la povidona yodada (Chaiyakunapruk 2002). Sin embargo, el metanálisis sólo evaluó el gluconato de clorhexidina y la povidona yodada como antisépticos cutáneos, y algunos estudios incluidos en el mismo evaluaron una combinación de catéteres arteriales así como catéteres venosos centrales y periféricos. Aún quedan algunas dudas con respecto al mejor agente, o combinación de agentes, para el uso como antisepsia de la piel para el CVC solo; el intervalo óptimo entre la aplicación de los antisépticos, así como el mejor método para la aplicación de estos agentes. La revisión del último informe de la National Healthcare Safety Network, que reemplazó la National Nosocomial Infections Surveillance (NNIS 2004), reveló que la tasa de septicemia asociada con el CVC en diferentes UCI en los EE.UU. varía de 1,0 a 5,6 casos de septicemia por 1000 CVC‐días (Edwards 2008). Estas cifras se comparan favorablemente con las cifras anteriores de la NNIS de 2,7 a 7,4 casos de septicemia por 1000 CVC‐días (NNIS 2004). La mejoría observada en la tasa de septicemia asociada con el CVC probablemente es de naturaleza multifactorial, aunque las campañas educacionales y de concientización recientes acerca de las infecciones nosocomiales y la aplicación de medidas de control de infecciones en muchos hospitales de los EE.UU. pueden haber desempeñado una función. Aún no se conoce el impacto de los diferentes regímenes de antisepsia de la piel en presencia de medidas de control de infecciones integrales y de tasas iniciales de septicemia más bajas. Además, la disponibilidad de estudios nuevos que utilizan diferentes preparados de antisépticos cutáneos y la aparición continua de microorganismos farmacorresistentes requieren una revisión sistemática para ayudar en la toma de decisiones clínicas y para destacar las necesidades de la investigación futura (O'Grady 2002; Parienti 2004; Pratt 2007).
Objetivos
Evaluar los efectos de la antisepsia de la piel alrededor de los sitios del catéter venoso central, en las tasas de septicemia relacionada con el catéter, la colonización del catéter y la mortalidad y la morbilidad del paciente.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron ensayos controlados aleatorios (ECA) y ensayos controlados cuasialeatorios que comparaban un régimen de antisépticos cutáneos (un único agente o una combinación de agentes) con otro régimen (un único agente o una combinación de agentes, placebo o ninguna antisepsia). Se excluyeron los estudios cruzados por el posible efecto contaminante de una intervención sobre otra. También se excluyeron los estudios que evaluaban los CVC para la hemodiálisis, debido a que este tema está cubierto por otra revisión Cochrane (McCann 2010).
Tipos de participantes
Se incluyeron estudios en adultos y niños que recibieron atención en un ámbito hospitalario (en salas de adultos o pediátricas o UCI) con cualquier enfermedad subyacente y un CVC insertado por cualquier motivo durante el período de estudio. Los estudios que seleccionaron a un paciente más de una vez fueron aceptables siempre que la inclusión tuviese lugar en ingresos hospitalarios separados. Se excluyeron los estudios realizados en ámbitos neonatales, por ejemplo en una unidad de cuidados intensivos neonatales (UCIN), debido a que los tipos de catéteres usados, el sitio de inserción y las técnicas, las posibles complicaciones así como los factores de riesgo de sepsis son diferentes en comparación con los de los niños mayores y los adultos (Trieschmann 2007).
Tipos de intervenciones
Intervención
El uso de cualquier régimen de antisépticos cutáneos (un único agente o una combinación de agentes) utilizado para limpiar la piel alrededor de los sitios de inserción del CVC.
Comparaciones
Un régimen de antisepsia de la piel diferente (un único agente o una combinación de agentes), placebo o ninguna antisepsia de la piel para los sitios de inserción del CVC.
Se requirió que la selección, la inserción, el uso, el mantenimiento y la extracción del CVC en los grupos de intervención y de comparación siguieran el protocolo estándar del ámbito hospitalario en el estudio. El régimen de antisepsia de la piel debía ser la única diferencia sistemática entre los grupos de comparación (es decir, no el material del catéter o las medidas antisépticas concurrentes relacionadas con el CVC).
Se aceptó la duración de los estudios según lo especificado por los autores de varias maneras. No se impusieron límites en la duración mínima y máxima del período de seguimiento para cada estudio.
Tipos de medida de resultado
Resultados primarios
Número de pacientes con septicemia relacionada con el CVC
-
Septicemia relacionada con el catéter confirmada por el laboratorio
-
Septicemia primaria o sepsis clínica.
Se presentan los criterios para el diagnóstico de la septicemia relacionada con el CVC en el Apéndice 2 (Pagani 2008).
Mortalidad
-
Mortalidad por todas las causas
-
Mortalidad atribuible a las infecciones relacionadas con el CVC.
Se incluyeron los estudios apropiados mediante el uso de otras definiciones de las infecciones relacionadas y asociadas con el CVC, siempre que los autores justificaran sus definiciones con fuentes válidas.
Resultados secundarios
-
Número de pacientes con infección del sitio de inserción, ya sea documentada microbiológicamente (es decir los exudados del sitio de inserción del catéter producen un microorganismo con o sin septicemia concomitante) o documentada clínicamente (es decir eritema o induración dentro de los 2 cm del sitio de inserción del catéter en ausencia de septicemia asociada y sin purulencia acompañante) (Pagani 2008)
-
Número de pacientes con colonización del catéter, según lo definido por los autores de los estudios mediante definiciones bien aceptadas como un crecimiento significativo del microorganismo (más de 15 unidades formadoras de colonias [CFU ]) a partir del extremo del catéter, el segmento subcutáneo o el mandril del catéter en ausencia de signos clínicos de infección (Pagani 2008)
-
Número de organismos farmacorresistentes a partir de los cultivos, incluidos los cultivos del sitio de inserción, los cultivos del catéter y los hemocultivos
-
Número de eventos adversos asociados con el uso de agentes antisépticos, incluida la irritación de la piel, la dermatitis de contacto, la reacción alérgica sistémica y la anafilaxia
-
Uso de antibióticos durante la hospitalización
-
Duración de la hospitalización, ya sea la estancia en la UCI o la estancia hospitalaria general
-
Costo de la atención, incluido el costo del agente antiséptico y el costo del tratamiento de cualquier efecto adverso
-
Calidad de vida, medida mediante instrumentos validados.
Results
Description of studies
Results of the search
We identified 609 records from the initial search of the Cochrane Wounds Group Specialised Register, CENTRAL, MEDLINE, EMBASE and CINAHL. We performed additional searches from relevant published studies and identified two further studies that appeared to be relevant. After removing duplicates, there were 574 records. Of these, 107 articles appeared to be relevant after we inspected the titles. We evaluated the abstracts and if necessary, the full text of the articles, excluding 84 of the 107 records, including one duplicate publication of another excluded study. Of the remaining 23 articles, one was an ongoing study, and we could not fully assess six as we are still awaiting their full texts or further information from the authors. Ultimately, 16 articles describing 13 studies were available and met our inclusion criteria. Among these 16 articles, three were additional publications relating to three included studies. The flow diagram of the studies from the initial search to the meta‐analysis is shown in Figure 1. We describe all the included studies in the Characteristics of included studies table and note the reasons for excluding the others in the Characteristics of excluded studies table.

Study flow diagram.
Included studies
We included 13 RCTs, conducted in eight countries, including the USA (four studies), France (two studies), and Canada, Germany, Iran, Japan, Spain, Switzerland and Finland (1 study each). Ten trials were single centre RCTs and three were multicentre RCTs (Dettenkofer 2010; Humar 2000; Yasuda 2013) The number of patients recruited ranged from 50 (with 50 CVCs) in Sadowski 1988 to 420 (with 998 CVCs) in Vallés 2008. Mimoz 1996, Mimoz 2007 and Yasuda 2013 did not report the number of participants. Prager 1984 recruited children (n = 3) in addition to adults (in this case, n = 159), while Sadowski 1988 recruited children and adolescent from 10 weeks to 15 years of age. All studies included participants of both sexes.
Six studies recruited patients from the medical/surgical ICUs (Maki 1991; Mimoz 1996; Mimoz 2007; Vallés 2008; Tuominen 1981; Yasuda 2013), two studies recruited patients who were either pre‐ or post‐cardiac surgery (Levy 1988; Yousefshahi 2013), one study enrolled patients from a burns unit (Sadowski 1988), one from haematology and surgical units (Dettenkofer 2010) and the remaining three studies were conducted hospital‐wide, which included intensive‐care and non intensive‐care patients (Humar 2000; Langgartner 2004; Prager 1984). The average duration of catheterisation, where reported, varied from 2 to 21.1 days (range 1 to > 30 days).
There were ten basic comparisons between two or three arms in the included studies, with subgroups based on type of solution in two comparisons.
-
Comparison 1: povidone‐iodine (in aqueous solution) versus no skin antisepsis (Prager 1984).
-
Comparison 2: chlorhexidine (in aqueous solution) versus no skin antisepsis (Tuominen 1981).
-
Comparison 3: alcohol versus no skin antisepsis (Sadowski 1988).
-
Comparison 4: chlorhexidine versus povidone‐iodine (Humar 2000; Maki 1991; Mimoz 2007; Vallés 2008; Yasuda 2013). The specific subgroups for this comparison are listed below based on the different preparations of chlorhexidine and/or povidone‐iodine:
-
-
Chlorhexidine in aqueous solution versus povidone‐iodine in aqueous solution (Maki 1991; Vallés 2008).
-
Chlorhexidine in alcohol versus povidone‐iodine in aqueous solution (Humar 2000; Vallés 2008).
-
Chlorhexidine in alcohol versus povidone‐iodine in alcohol (Mimoz 2007).
-
Chlorhexidine in alcohol versus povidone‐iodine (base solution unknown) (Yasuda 2013).
-
Among the studies included in this comparison, two (Vallés 2008; Yasuda 2013) carried out three‐arm comparison. Vallés 2008 compared 2% chlorhexidine in aqueous solution (group 1), 0.5% chlorhexidine in alcohol (group 2) and 10% povidone‐iodine in aqueous solution (group 3), while Yasuda 2013 compared 1% chlorhexidine in alcohol (group 1), 0.5% chlorhexidine in alcohol (group 2) and 10% povidone‐iodine (base solution unknown). Because the authors of Yasuda 2013 did not specify the base solution for the povidone‐iodine group, we could not include this study in any subgroup in our meta‐analysis.
-
Comparison 5: chlorhexidine (aqueous) versus alcohol (Maki 1991).
-
Comparison 6: povidone‐iodine versus alcohol.
-
Comparison 7: alcohol versus octenidine in alcohol (Dettenkofer 2010).
-
Comparison 8: chlorhexidine (in alcohol) plus povidone‐iodine (in aqueous solution) versus chlorhexidine in alcohol (Langgartner 2004).
-
Comparison 9: chlorhexidine (in alcohol) plus povidone‐iodine (in aqueous solution) versus povidone‐iodine (in aqueous solution) (Langgartner 2004).
-
Comparison 10: Sanosil (hydrogen peroxide and silver) versus water as adjunct to chlorhexidine 2% aqueous bath plus povidone‐iodine 10% aqueous scrub (Yousefshahi 2013).
In terms of the timing of intervention, most studies assessed skin antisepsis prior to insertion and regularly thereafter during the in‐dwelling period of the catheters, ranging from every 24 h to every 72 h. Three studies evaluated the skin antisepsis intervention only prior to catheter insertion (Levy 1988; Yasuda 2013; Yousefshahi 2013), and one study examined skin antisepsis prior to removal of the catheters (Sadowski 1988). Maki 1991 and Mimoz 1996 evaluated central venous as well as arterial catheters, although only Maki 1991 provided a separate report of patients receiving CVCs for the outcomes of catheter‐related BSI and catheter colonisation, while only Mimoz 1996 provided CVC‐specific reports for both outcomes per 1000 catheter‐days.
The concentration of chlorhexidine‐based solution used in the studies ranged from 0.05% to 2%, with three studies using a combination of chlorhexidine plus alcohol. The concentration of povidone‐iodine was 10% in all studies except Mimoz 2007, which used 5% povidone‐iodine together with 70% ethanol. All of the studies that evaluated alcohol used 70% isopropyl alcohol except Dettenkofer 2010, which used a combination of 45% 2‐propanol or 74% ethanol with 10% 2‐propanol.
In terms of concomitant CVC‐related infection control measures, six studies clearly described the use of maximal sterile barrier precaution (Dettenkofer 2010; Humar 2000; Langgartner 2004; Mimoz 1996; Mimoz 2007; Vallés 2008), three studies described part of the maximal sterile precaution (such as the use of sterile gloves, gown or dressing) without explicitly mentioning maximal sterile precaution (Levy 1988; Maki 1991; Yousefshahi 2013), and four studies did not provide any clear description (Prager 1984; Sadowski 1988; Tuominen 1981; Yasuda 2013).
The included studies assessed almost exclusively two major outcomes, namely, catheter colonisation or equivalent (all 13 studies) and catheter‐related BSI or equivalent (8 studies). The other outcomes assessed were sepsis, skin colonisation, insertion site infection, number of patients who required antibiotics during the period of catheter use and adverse effects (only evaluated in one study). Only one study reported mortality (Vallés 2008), and no study reported cost of care or quality of life.
Control group risk of infection varied from 6.0% to 32.0% for catheter colonisation, and from 4.1% to 9.8% for catheter‐related BSI.
Of the eight studies that evaluated the primary outcome of catheter‐related BSI, all except Yasuda 2013 clearly defined this outcome in line with our definitions, detailed in Appendix 2. The exact wording varied among the studies, but the definitions involved a positive blood culture in the presence of catheter with clinical evidence of sepsis, improvement of the clinical signs following removal of the catheters or both. One study (Yousefshahi 2013) used the Centers for Disease Control and Prevention (CDC) definitions of catheter‐related BSI (CDC 2011), which were also consistent with the definitions adopted in this review. Most studies used previously validated laboratory methods to perform catheter and blood cultures, adopting microbiological definitions for colonisation and bloodstream infection that were consistent with published literature in the evaluation of catheter‐related infections, including the use of molecular subtyping. In Yasuda 2013, the published abstract did not contain the definition of catheter‐related BSI.
All studies reported catheter‐related outcomes such as catheter‐related BSI and catheter colonisation using the catheter as the unit of analysis. Ten of the 13 included studies provided the number of participants alongside the number of catheters, although none provided separate reports of the catheter‐related outcomes using participants as the unit of analysis. The number of catheters matched the number of participants in six studies (Dettenkofer 2010; Levy 1988;Humar 2000; Maki 1991; Sadowski 1988; Yousefshahi 2013); in three studies, the number of catheters exceeded the number of participants: by 10% in Prager 1984, 18% in Langgartner 2004 and 50% in Vallés 2008. In Tuominen 1981, there were fewer catheters analysed than participants enrolled, with no reason provided.
We did not incorporate the outcome data of Yasuda 2013 into our meta‐analysis, as it was published only as an abstract and did not state the base solution used (either aqueous or alcohol) for the povidone‐iodine group. We are awaiting further information from the authors.
In terms of funding source, one study (Dettenkofer 2010) received funding from a national research agency, five studies (Humar 2000; Maki 1991; Mimoz 1996; Mimoz 2007; Prager 1984) were funded in whole or in part by a pharmaceutical company, and in the remaining seven studies (Langgartner 2004; Levy 1988; Sadowski 1988; Tuominen 1981; Vallés 2008; Yasuda 2013; Yousefshahi 2013), the sources of funding were not stated.
Excluded studies
We excluded a total of 83 articles based on one or more of the following reasons.
-
Study design or article type (54 studies): the studies were either retrospective or prospective cohort studies, cross‐over study, before‐and‐after intervention studies, prospective non‐randomised intervention studies, meta‐analyses, economic analyses with no original trial data, in vitro experiments, studies with research questions or outcomes that did not match our review, commentaries or an abstract of an included study, excluded study or a study awaiting classification.
-
Population (17 studies): the participants in the studies were either neonates, people undergoing haemodialysis or all patients in ICU, not only those with CVCs in place.
-
Intervention (25 studies): the studies either assessed antimicrobial‐impregnated dressing or cerebral ventricular catheter.
-
Insufficient information (four studies): the studies either reported combined outcome data for arterial, venous or Swan Gantz catheters (or a combination of these), with no separate reporting for venous catheter and little possibility of contacting the authors for further information, or they reported outcome data that were unsuitable for meta‐analysis.
Among the excluded articles, three articles were merged with other articles as their secondary references on the basis of duplication of information as stated under reason number 1 above, including two included studies (Maki 1991; Mimoz 1996) and one excluded study (Garland 2009b).
A description of each study is available in the 'Characteristics of excluded studies' table.
Risk of bias in included studies
There was a wide variation in the risk of bias of the included studies. Overall, there was approximately a one‐third split in the domains that were judged to be low risk, unclear risk and high risk. There was at least one high‐risk domain in each of the included studies. All studies were judged to be at high risk for blinding of participants, except Dettenkofer 2010 (low risk) and Yousefshahi 2013 (unclear risk). Yasuda 2013 had unclear risks of bias in all domains, as there was insufficient information in the published abstract. The proportions of included studies with low, high and unclear risks of bias in each domain is illustrated in Figure 2, and the risk of bias judgment of each included study in each domain is depicted in Figure 3. Additionally, we have provided a detailed description of the risk of bias of each study in the 'Characteristics of included studies' table. We summarise our risk of bias assessments for each domain below.
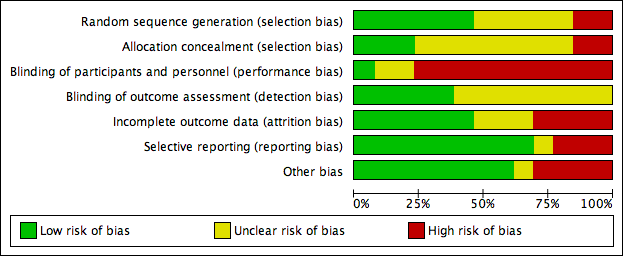
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
For random sequence generation, we judged 6 of the 13 included studies to have low risk of bias (Dettenkofer 2010; Humar 2000; Mimoz 1996; Mimoz 2007; Tuominen 1981; Vallés 2008). For allocation concealment, three studies had low risk of bias (Dettenkofer 2010; Langgartner 2004; Mimoz 2007). In these studies, the authors clearly stated the method of sequence generation, which involved some form of random number scheme, mostly by computers. There were also clear statements in the 'Methods' that reassured the readers of the independence between sequence generation and allocation. Two studies were judged to be at high risk in sequence generation as well as allocation concealment, as they allocated participants either using an alternate sequence or based on their hospital registration numbers (Prager 1984; Yousefshahi 2013). There was an unclear risk of bias in one or both domains for 8 of the 13 included studies due to insufficient information provided in the articles.
Blinding
All of the studies except Dettenkofer 2010, Yasuda 2013 and Yousefshahi 2013 had a high risk of bias with regard to blinding of participants. Maki 1991, Mimoz 1996 and Mimoz 2007 clearly stated that they did not blind participants, while other studies did not specify. However, blinding was considered very unlikely in these studies because they compared either a skin antisepsis regimen against no regimen, one skin antisepsis solution against another with a different appearance, or a skin antisepsis regimen against a different and clearly distinguishable infection control measure with no documented attempt to mask the participants.
Eight studies did not report blinding of outcome assessors (Humar 2000; Langgartner 2004; Levy 1988; Prager 1984; Sadowski 1988; Tuominen 1981; Yasuda 2013; Yousefshahi 2013), while the other five did not make any clear statements one way or the other (Dettenkofer 2010; Maki 1991; Mimoz 1996; Mimoz 2007; Vallés 2008). Although investigators objectively measured the outcome of catheter colonisation, catheter‐related BSI required some degree of clinical judgment, which might have been affected by lack of blinding.
Incomplete outcome data
We judged studies to have a high risk of attrition bias for the following three reasons, alone or in combination:
-
High absolute attrition rates (≥ 20% attrition) or an attrition rate that was higher than the event rates in the control group
-
Vulnerability of the pooled estimates to best‐ and worst‐case scenarios using the dropouts in the assigned groups
-
Marked imbalance in the attrition rates between the assigned groups.
Four studies had high risk of bias in this domain either because they had more than 20% withdrawals (Dettenkofer 2010; Humar 2000; Langgartner 2004) or because their results changed significantly with best‐ and worst‐case scenarios (Vallés 2008). Six studies had low risk of bias (Levy 1988; Maki 1991; Mimoz 2007; Prager 1984; Sadowski 1988; Yousefshahi 2013), and the information on withdrawal was not sufficient in the remaining three studies (Mimoz 1996; Tuominen 1981; Yasuda 2013).
Selective reporting
Nine studies had low risk of reporting bias (Dettenkofer 2010; Humar 2000; Maki 1991; Mimoz 1996; Mimoz 2007; Prager 1984; Sadowski 1988; Tuominen 1981; Yousefshahi 2013), and three studies carried a high risk (Langgartner 2004; Levy 1988; Sadowski 1988). The three studies that were judged to have high risk of reporting bias did not report key outcomes that would be expected in such types of studies, such as catheter‐related BSI, clinical sepsis or mortality.
Other potential sources of bias
We screened for other potential sources of bias including extreme baseline imbalance, block randomisation of unblinded trials, unit of analysis issues and any evidence of fraud. As blinding was highly unlikely in most included studies, the use of block randomisation posed an additional risk of bias due to the possibility of disrupting the integrity of the random sequence with educated guess on the likely allocation of the future participants (Higgins 2011a). Two studies (Humar 2000; Vallés 2008) were judged to have high risk under 'other potential sources of bias' as they used block randomisation, and the authors did not state whether they used varying block sizes in either trial.
Unit of analysis issues were a particular concern in three studies (Langgartner 2004; Prager 1984; Vallés 2008), in which the number of catheters analysed exceeded the total number of participants. This meant that some participants had multiple catheters analysed in the study as the authors of the three studies did not limit one catheter per participants in the analyses. The results might have been affected as the outcomes data from multiple catheters from the same participants were most likely not independent from each other. A more detailed description of the risk of bias of the trials is provided in 'Assessment of risk of bias in included studies'.
Effects of interventions
In this review, we assessed outcomes for a total of 3446 catheters in our meta‐analysis of 12 studies. The total number of participants was unclear as some studies did not report this detail. Overall, we carried out 10 comparisons, with variations related to the base solution in comparisons 4 and 6.
-
Comparison 1: povidone‐iodine (in aqueous solution) versus no skin antisepsis (Prager 1984).
-
Comparison 2: chlorhexidine (in aqueous solution) versus no skin antisepsis (Tuominen 1981).
-
Comparison 3: alcohol versus no skin antisepsis (Sadowski 1988).
-
Comparison 4: chlorhexidine versus povidone‐iodine.
-
Chlorhexidine in aqueous solution versus povidone‐iodine in aqueous solution (Maki 1991; Vallés 2008).
-
Chlorhexidine in alcohol versus povidone‐iodine in aqueous solution (Humar 2000; Vallés 2008).
-
Chlorhexidine in alcohol versus povidone‐iodine in alcohol (Mimoz 2007).
-
-
Comparison 5: chlorhexidine (in aqueous solution) versus alcohol (Maki 1991).
-
Comparison 6: povidone‐iodine versus alcohol.
-
Comparison 7: alcohol versus octenidine in alcohol (Dettenkofer 2010).
-
Comparison 8: chlorhexidine (in alcohol) plus povidone‐iodine (in aqueous solution) versus chlorhexidine in alcohol (Langgartner 2004).
-
Comparison 9: chlorhexidine (in alcohol) plus povidone‐iodine (in aqueous solution) versus povidone‐iodine (in aqueous solution) (Langgartner 2004).
-
Comparison 10: Sanosil (hydrogen peroxide and silver) versus water as adjunct to chlorhexidine 2% aqueous bath plus povidone‐iodine 10% aqueous scrub (Yousefshahi 2013).
Below, we report on our outcomes of interest in order of the comparisons that examined them.
Primary outcomes
Catheter‐related BSI
Comparison 1: aqueous povidone iodine versus no skin antisepsis (1 RCT, 179 catheters)
Prager 1984 was the only study that compared povidone iodine in aqueous solution versus with no skin antisepsis (dry dressing). There was no clear evidence of a difference in the rate of catheter‐related BSI (RR 0.99, 95% CI 0.37 to 2.61; 179 catheters; Analysis 1.1). The estimate is very uncertain as the comparison was underpowered to detect important differences in the outcome. The quality of evidence for this outcome was rated as very low due to very serious risk of bias issues (random sequence generation, allocation concealment, non‐blinding of participants and unit of analysis issue) as well as imprecision.
Comparisons 2: aqueous chlorhexidine versus no skin antisepsis and comparison 3: alcohol versus no skin antisepsis
No study reported this outcome for these comparisons.
Comparison 4: chlorhexidine versus povidone‐iodine (4 RCTs, 1436 catheters)
Overall, chlorhexidine (any solution) was associated with a lower rate of catheter‐related BSI than povidone‐iodine (any solution) (absolute risk reduction (ARR) of 2.30%, 95% confidence interval (CI) 0.06% to 3.70%; risk ratio (RR) 0.64, 95% CI 0.41 to 0.99; NNTB 44, 95% CI 27 to 1563; four studies, 1436 catheters, I2 = 0%; Analysis 4.1; Figure 4). This evidence was very low quality, downgraded for imprecision (one level) and risks of bias (two levels) in allocation concealment, blinding of participants and unit of analysis issues under "other sources of bias". Analyses of subgroups according to the base solution used showed no clear differences between chlorhexidine and povidone‐iodine in the rates of catheter‐related BSI: chlorhexidine in aqueous solution versus povidone‐iodine in aqueous solution (RR 0.64, 95% CI 0.32 to 1.28, 2 studies, 452 catheters, I2 = 15%), chlorhexidine in alcohol versus povidone‐iodine in aqueous solution (RR 0.77, 95% CI 0.39 to 1.53; 2 studies, 503 catheters, I2 = 0%), chlorhexidine in alcohol versus povidone‐iodine in alcohol (RR 0.40, 95% CI 0.13 to 1.24; 1 study, 481 catheters). The small number of trials in each subgroup means that the comparisons were underpowered, and the results are uncertain. We considered the evidence from the data to be of very low overall quality (downgraded for imprecision (one level) and risks of bias (two levels) in allocation concealment, blinding of participants and unit of analysis issues. We have highlighted the results for these outcomes from the overall comparison of chlorhexidine versus povidone‐iodine as well as the three subgroup comparisons in our summary of findings Table for the main comparison.
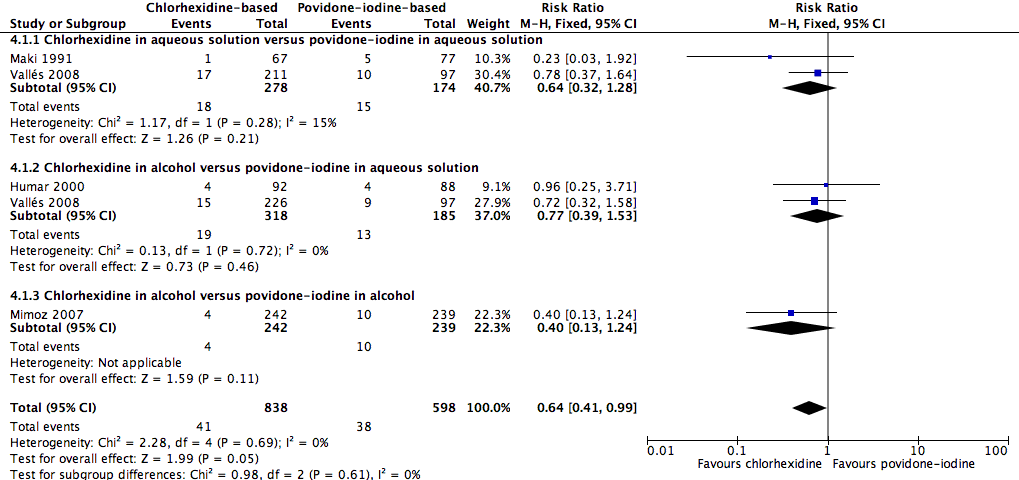
Forest plot of comparison: 1 Chlorhexidine versus povidone‐iodine, outcome: 1.1 Catheter‐related BSI.
For the outcome of catheter‐related BSI per 1000 catheter‐days, chlorhexidine was associated with an apparent lower BSI rate compared with povidone‐iodine (RR 0.53, 95% CI 0.30 to 0.94; 4 studies, 1450 catheters, I2 = 0%; Analysis 4.2). Analyses of subgroups according to the base solution used found evidence of a possible difference between chlorhexidine in alcohol versus povidone‐iodine in aqueous solution (RR 0.49, 95% CI 0.25 to 0.95; 3 studies, 661 catheters, I2 = 31%), but relative effects were unclear for the other base solutions in comparison (chlorhexidine in aqueous solution versus povidone‐iodine in aqueous solution (RR 0.82, 95% CI 0.23 to 2.93; 1 study, 308 catheters), and chlorhexidine in alcohol versus povidone‐iodine in alcohol (RR 0.41, 95% CI 0.06 to 2.92; 1 study, 481 catheters). All subgroup comparisons were underpowered and the overall quality of evidence for this outcome was very low due to very serious risk of bias issues (non‐blinding of participants, incomplete outcome data and unit of analysis issues).
Comparison 5: aqueous chlorhexidine versus alcohol (1 RCT, 99 catheters)
A single small study compared chlorhexidine in aqueous solution with alcohol (Maki 1991) and found no clear difference in the absolute rate of catheter‐related BSI between the alcohol‐based solution and the chlorhexidine‐based solution (RR 0.24, 95% CI 0.02 to 2.54; 99 catheters; Analysis 5.1). The comparison was underpowered and the quality of evidence for this outcome was low due to risk of bias of the study (non‐blinding) and imprecision.
Comparison 6: aqueous povidone‐iodine versus alcohol (1 RCT, 109 catheters)
Maki 1991, the only study that compared povidone‐iodine in aqueous solution with alcohol did not find a clear difference in the rate of catheter‐related BSI between the two groups (RR 1.04, 95% CI 0.24 to 5.08; 109 catheters; Analysis 6.1). The comparison was underpowered and the quality of evidence for this outcome was low due to risk of bias issue (non‐blinding of the participants) and imprecision.
Comparison 7: alcohol versus octenidine in alcohol (1 RCT, 387 catheters)
Dettenkofer 2010 was the only study to compare alcohol versus octenidine in alcohol, and found no clear difference between groups in the absolute rate of catheter‐related BSI (RR 2.01, 95% CI 0.88 to 4.59; 387 catheters; Analysis 7.1) or catheter‐related BSI per 1000 catheter‐days (RR 2.18, 95% CI 0.54 to 8.77; 387 catheters; Analysis 7.2). The comparison was underpowered and the quality of evidence for both outcomes was low due to risk of bias issue (incomplete outcome data) and imprecision.
Septicaemia (whether or not CVC‐related)
Comparison 2: chlorhexidine versus no skin antisepsis (1 RCT, 136 participants)
The only study that reported the outcome of septicaemia (irrespective of its relationship with CVC) was Tuominen 1981, which compared chlorhexidine with no skin antisepsis. This study of 136 participants compared the use of 0.05% chlorhexidine in aqueous solution with no skin antisepsis and found no clear difference in the rate of septicaemia between the two groups, but the result was inconclusive due to imprecision (RR 2.91, 95% CI 0.31 to 27.31; Analysis 2.1). The quality of evidence for this outcome was low due to risk of bias issue (non‐blinding of participants) and imprecision, as stated above.
Mortality (all‐cause or CVC‐related)
Comparison 4: chlorhexidine versus povidone‐iodine (1 RCT, 329 participants analysed, 106 participants in povidone‐iodine group were included in both subgroup comparisons below)
A single study (Vallés 2008) reported mortality. The study divided the participants into three groups: chlorhexidine in aqueous solution, chlorhexidine in alcohol and povidone‐iodine in aqueous solution. Analyses according to subgroups showed no clear differences in the rates of mortality between chlorhexidine in aqueous solution and povidone‐iodine in aqueous solution (RR 1.15, 95% CI 0.72 to 1.83; 213 participants) (Analysis 4.3), or between chlorhexidine in alcohol and povidone‐iodine in aqueous solution (RR 0.80, 95% CI 0.48 to 1.34; 222 participants) (Analysis 4.3)(Figure 5). However, the comparison was underpowered to detect important differences in the outcome, and the quality of evidence for both analyses was low due to a combination of risk of bias issues and imprecision in the outcome estimates (summary of findings Table for the main comparison). Consequently true differences in the mortality associated with use of chlorhexidine or povidone iodine cannot be ruled out.

Forest plot of comparison: 1 Chlorhexidine versus povidone‐iodine, outcome: 1.3 All‐cause mortality.
Secondary outcomes
Catheter colonisation
Comparison 1: aqueous povidone‐iodine versus no skin antisepsis (1 RCT, 179 catheters)
Based on Prager 1984, the only study in this underpowered comparison, it is unclear whether there is any difference in the effect on catheter colonisation of aqueous povidone iodine and no skin antisepsis (RR 0.93, 95% CI 0.53 to 1.60; 179 catheters; Analysis 1.2). There was very low quality evidence due to serious risk of bias (random sequence generation, allocation concealment, non‐blinding of participants and unit of analysis issue) and indirectness of the outcome.
Comparison 2: aqueous chlorhexidine versus no skin antisepsis (1 RCT, 124 catheters)
Based on Tuominen 1981, the only study to compare chlorhexidine in aqueous solution with no skin antisepsis, there was no clear difference in the rate of catheter colonisation and therefore uncertainty as to their relative effects remains (RR 1.26, 95% CI 0.61 to 2.59; 124 catheters; Analysis 2.2). The quality of evidence was very low due to risk of bias (non‐blinding of participants), indirectness of the outcome and imprecise estimate from an underpowered analysis.
Comparison 3: alcohol versus no skin antisepsis (1 RCT, 50 catheters)
Based on a single study in this underpowered analysis (Sadowski 1988), it remains unclear whether there is a difference between cleansing the skin with alcohol and no skin antisepsis prior to catheter removal (RR 0.75, 95% CI 0.30 to 1.85; 50 catheters; Analysis 3.1). The quality of evidence was very low due to risk of bias (non‐blinding of the participants), indirectness and imprecision.
Comparison 4: chlorhexidine versus povidone‐iodine (5 RCTs, 1533 catheters)
Pooled analysis of five studies that compared chlorhexidine with povidone iodine showed an overall reduction in the risk of catheter colonisation with chlorhexidine (RR 0.68, 95% CI 0.56 to 0.84; ARR 8%, 95% CI 3 to 12%; NNTB 13, 95% CI 9 to 34; 5 studies, 1533 catheters, I2 = 55%; Analysis 4.4; Figure 6). Analysing subgroups according to the solution, there appeared to be reductions in rates of catheter colonisation favouring chlorhexidine in the following comparisons:

Forest plot of comparison: 1 Chlorhexidine versus povidone‐iodine, outcome: 1.4 Catheter colonisation.
-
Chlorhexidine in aqueous solution versus povidone‐iodine in aqueous solution (RR 0.60, 95% CI 0.40 to 0.91; 2 studies, 442 catheters, I2 = 56%).
-
Chlorhexidine in alcohol versus povidone‐iodine in alcohol (RR 0.52, 95% CI 0.34 to 0.80; 1 study, 481 catheters).
However, the rate of catheter colonisation between chlorhexidine in alcohol versus povidone‐iodine in aqueous solution appeared to be similar (RR 0.86, 95% CI 0.64 to 1.14; 3 studies, 600 catheters, I2 = 58%).
There was moderate heterogeneity present for the overall pooled analysis, as indicated by the I2 of 55%. The extent of heterogeneity remained even with the studies separated into subgroups according to the solution used, as shown above. We investigated other possible sources of heterogeneity by exploring factors that were present in the population, intervention, comparison, outcome definitions and risk of bias among the included studies. We noted that although there were some differences in the characteristics of the included studies in terms of population (surgical versus cardiac versus general ICUs) and intervention (different concentrations of chlorhexidine used, duration of catheterisation and the concurrent use of other antiseptic substances alongside chlorhexidine‐based solution), these differences did not plausibly explain the degree of heterogeneity, as separating the studies into subgroups according to these factors did not reduce the degree of heterogeneity.
However, we identified one plausible source of heterogeneity under the risk of bias criterion. We found that only two out of five included studies (Maki 1991; Mimoz 1996) had low risk of attrition bias, while the other three were at high risk of bias in this domain. The two studies with low risk of attrition bias showed significant benefits of chlorhexidine compared with povidone‐iodine, whilst the remaining studies showed no significant difference between the two groups. Grouping studies with low risk and high risk of attrition bias separately reduced the I2 statistic to 0% and 41%, respectively.
We undertook best‐ and worst‐case scenarios to determine the impact of missing data from these three studies and found that the overall pooled analysis was substantially altered, with the best‐case scenario moving the direction of the pooled estimate to significantly and substantially favour the chlorhexidine group, and the worst‐case scenario moving the pooled estimate to significantly favour the povidone‐iodine group (see 'Sensitivity analysis' for details).
Having identified a plausible explanation for the observed heterogeneity, we still decided to combine all five studies under three different subgroups according to the type of solution used (either aqueous or alcohol). Taking all considerations, the overall quality of evidence for this outcome was very low, as there were very serious concerns regarding risk of bias (non‐blinding of participants, incomplete outcome data and unit of analysis issue), indirectness of the outcome and inconsistency among the study results.
Comparison 5: aqueous chlorhexidine versus alcohol (1 RCT, 99 catheters)
According to a single study (Maki 1991), it remains unclear whether there is a difference in the rates of catheter colonisation between chlorhexidine in aqueous solution and alcohol (RR 0.38, 95% CI 0.11 to 1.33; 99 catheters; Analysis 5.2), but the comparison was underpowered. The quality of evidence for this outcome was very low due to risk of bias (non‐blinding of participants), indirectness and imprecision.
Comparison 6: aqueous povidone‐iodine versus alcohol (3 RCTs, 169 catheters)
It is unclear whether there is a difference in the rates of catheter colonisation between patients who received CVC cleansing with povidone‐iodine and those who receive cleansing with alcohol, either overall (RR 1.76, 95% CI 0.76 to 4.09; 2 studies, 169 catheters, I2 = 43%), or in subgroups comparing povidone‐iodine in aqueous solution versus alcohol (RR 1.25, 95% CI 0.49 to 3.14; 1 study, 109 catheters) or povidone‐iodine‐impregnated adherent film versus alcohol (RR 9.00, 95% CI 0.51 to 160.17; 1 study, 60 catheters; Analysis 6.2). The comparisons were underpowered, and the overall quality of evidence for this outcome was very low due to risk of bias (non‐blinding of participants), indirectness of the outcome and imprecision.
Comparison 7: alcohol versus octenidine in alcohol (1 RCT, 322 catheters)
Dettenkofer 2010, the only study to compare alcohol versus octenidine in alcohol, showed that alcohol alone is probably associated with a higher rate of catheter colonisation compared to octenidine (RR 2.26, 95% CI 1.22 to 4.21; 322 catheters; Analysis 7.3). However, there appeared to be no clear difference between the two groups in terms of catheter colonisation per 1000 catheter‐days (RR 2.23, 95% CI 0.79 to 6.29; 322 catheters; Analysis 7.4). The quality of evidence for both outcomes was low, due to concerns in risk of bias (non‐blinding of participants) and indirectness of the outcomes.
Comparison 8: chlorhexidine in alcohol plus povidone‐iodine in aqueous solution versus chlorhexidine in alcohol (1 RCT, 88 catheters)
In an underpowered analysis from a single study (Langgartner 2004), a combination of chlorhexidine plus povidone‐iodine appeared to be associated with lower rate of catheter colonisation (RR 0.19, 95% CI 0.04 to 0.81; 88 catheters; Analysis 8.1) as well as catheter colonisation per 1000 catheter‐days (RR 0.19, 95% CI 0.06 to 0.59; 88 catheters; Analysis 8.2) compared with chlorhexidine alone, although the effects were uncertain due to the very low quality of evidence, which was reduced by risk of bias (non‐blinding of participants, incomplete outcome data, unit of analysis issue), indirectness and imprecision.
Comparison 9: chlorhexidine in alcohol plus povidone‐iodine in aqueous solution versus povidone‐iodine in aqueous solution (1 RCT, 95 catheters)
In another single‐study, underpowered analysis based on Langgartner 2004, there appeared to be lower rate of catheter colonisation (RR 0.15, 95% CI 0.04 to 0.62; 95 catheters; Analysis 9.1) as well as catheter colonisation per 1000 catheter‐days (RR 0.17, 95% CI 0.05 to 0.52; 95 catheters; Analysis 9.2) using a combination of chlorhexidine and povidone‐iodine compared with using povidone‐iodine alone, but the effects were very uncertain due to the very low quality of evidence, which was reduced by risk of bias (non‐blinding of participants, incomplete outcome data, unit of analysis issue), indirectness and imprecision.
Comparison 10: Sanosil (hydrogen peroxide and silver) versus water as adjunct to chlorhexidine 2% aqueous bath plus povidone‐iodine 10% aqueous scrub (1 RCT, 249 catheters)
From the single study in this underpowered comparison (Yousefshahi 2013), it is uncertain whether there is any clear difference between the two groups in the rate of catheter colonisation (RR 1.08, 95% CI 0.68 to 1.72; 249 catheters; Analysis 10.1) due to the very low quality of evidence, which was reduced by risk of bias (random sequence generation, allocation concealment), indirectness and imprecision.
Insertion site infection
Comparison 4: Chlorhexidine versus povidone‐iodine (1 RCT, 242 catheters)
Based on the result of a single study (Humar 2000) in an underpowered analysis, it is uncertain whether there is any clear difference between chlorhexidine (in alcohol) and povidone‐iodine (in aqueous solution) with regard to insertion site infection, as the quality of evidence was very low due to risk of bias (non‐blinding of the participants, incomplete outcome data), indirectness and imprecision. The authors reported this outcome as the mean CFU count (MD − 2.80, 95% CI − 9.10 to 3.50; 242 catheters; Analysis 4.6).
Skin colonisation
Comparison 7: Alcohol versus octenidine in alcohol (1 RCT, 365 catheters)
Based on the results of Dettenkofer 2010, using alcohol alone probably resulted in higher mean CFU compared with octenidine in alcohol (MD 79.00 CFUs, 95% CI 32.76 to 125.24; 365 catheters; Analysis 7.5). The quality of evidence was moderate as it was reduced by imprecision of the effect estimates from an underpowered analysis.
Adverse effects
Comparison 7: Alcohol versus octenidine in alcohol (1 RCT, 398 participants)
A single study, Dettenkofer 2010, reported the rates of various adverse effects on the skin, the definitions of which appeared to overlap. For example, the authors reported "skin irritation", "burning", "skin irritation and burning", "itching", "skin lesions", "burning and skin lesions", "itching and skin irritation" as the outcomes under adverse effects. To avoid duplication, we included only the most commonly reported adverse effect, namely, skin irritation. For this outcome, there was moderate quality evidence showing no clear difference between in adverse effect rates between patients whose CVC sites were cleansed with alcohol and those who were cleansed with octenidine in alcohol (RR 0.85, 95% CI 0.60 to 1.20; 398 participants; Analysis 7.6). The quality of evidence was reduced by imprecision of the effect estimates from an underpowered analysis.
Number of patients who were on antibiotics during the period of catheter use
Comparison 2: Chlorhexidine in aqueous solution versus no skin antisepsis ( 1 RCT, 136 participants)
The only study that evaluated this outcome, Tuominen 1981 found no clear difference between the two groups with regard to the number of patients who required antibiotics during the period of catheter use (RR 0.84, 95% CI 0.55 to 1.27; 136 participants; Analysis 2.3). The quality of evidence was low due to risk of bias (non‐blinding of participants) and imprecision from an underpowered analysis.
Number of drug‐resistant organisms from culture, length of hospitalisation, cost of care and quality of life
No studies in any comparison assessed these outcomes.
Subgroup analyses
Other than separating the subgroups according to the type of solution used in comparisons 4 and 6, we did not perform any additional subgroup analyses as specified in our 'Methods' because the data in each study were not presented separately for various potential subgroups (for short term versus longer term CVCs, for paediatric versus adult patients and for patients in ICU versus those in other wards). Likewise, there was only a single study included in many comparisons, and all studies in the meta‐analysis used diagnostic criteria for catheter‐related infections that were in line with our pre‐specified criteria (see 'Included studies').
Sensitivity analysis
We performed sensitivity analyses on the most commonly assessed outcomes, namely, catheter‐related BSI (primary outcome) and catheter colonisation (secondary outcome) to evaluate the impact of excluding some studies based our predefined criteria (unclear or no allocation concealment (selection bias) and significant dropout rates (attrition bias)). We assessed the impact of missing data in studies with high dropout rates using the best‐ and worst‐case scenarios. We did not carry out a sensitivity analysis according to the criterion of blinding because we considered that all but one study were at high risk in this domain.
Catheter‐related BSI
Comparison 4: Chlorhexidine versus povidone‐iodine
Selection bias: None of the four studies included were at low risk of bias for both random sequence generation and allocation concealment. Maki 1991 was at unclear risk for both items while the other three studies were at low risk for at least one of the items. We decided to perform the sensitivity analysis by excluding Maki 1991. While the point estimate changed only slightly, the confidence interval expanded to cross the line of no effect, shifting the result to become non‐significant (before exclusion: RR 0.64, 95% CI 0.41 to 0.99; after exclusion: RR 0.68, 95% CI 0.43 to 1.08).
Attrition bias: Two studies had a high risk of attrition bias (Humar 2000, Vallés 2008). We conducted best‐ and worst‐case scenarios by assuming the outcome for the patients with missing data as described in the Dealing with missing data section. The direction of the pooled estimate differed markedly between the best‐ and worst‐case scenarios as well as from the actual results reported, namely the 'completer analysis' (best‐case scenario: RR 0.35, 95% CI 0.24 to 0.50, I2: 0%; worst‐case scenario: RR 1.47, 95% CI 1.01 to 2.14, I2: 64%; actual results reported: RR 0.64, 95% CI 0.41 to 0.99, I2: 0%).
There was only a single study included for all the other comparisons.
Catheter colonisation
Comparison 4: Chlorhexidine versus povidone‐iodine
Selection bias: One study (Maki 1991) had unclear risk of bias in both random sequence generation and allocation concealment, whilst the other studies were at low risk of bias for at least one item. The exclusion of Maki 1991 did not result in a substantial change in the pooled estimates (before exclusion: RR 0.68, 95% CI 0.56 to 0.84; after exclusion: RR 0.72, 95% CI 0.58 to 0.88).
Attrition bias: Three of the five studies (Humar 2000; Langgartner 2004; Vallés 2008) included in this comparison had high or unclear risk of attrition bias. We conducted best‐ and worst‐case scenarios. With the best‐case scenario, the pooled estimate showed substantial reduction in the risk of catheter colonisation favouring the chlorhexidine group (RR 0.56, 95% CI 0.47 to 0.68, I2: 73%), and with the worst‐case scenario, there was no significant difference between the two groups (RR 0.90, 95% CI 0.74 to 1.09, I2: 72%). Results from both the best‐ and worst‐case scenarios differed markedly with the actual results reported, namely the 'completer analysis' (RR 0.68, 95% CI 0.56 to 0.84, I2: 55%).
There were insufficient studies in all the other comparisons to enable a meaningful sensitivity analysis.
Discusión
Resumen de los resultados principales
Esta revisión identificó una variedad amplia de regímenes de antisepsia de la piel que comprendieron combinaciones diferentes de una sustancia activa (como clorhexidina) y solución de base (como solución acuosa o alcohólica). Sin embargo, un número limitado de estudios (y a veces sólo uno) examinó cada régimen. Basado en pruebas muy limitadas, no hubo diferencias claras entre los diversos regímenes de antisepsia de la piel para el resultado primario de la septicemia relacionada con el catéter, aunque para la comparación general entre la clorhexidina y la povidona yodada, pareció haber una reducción en la septicemia relacionada con el catéter asociada con la clorhexidina. En particular, dos estudios realizados en los años ochenta, uno que comparó povidona yodada en solución acuosa con ninguna antisepsia de la piel y otro que comparó clorhexidina en solución acuosa con ninguna antisepsia de la piel, no encontraron ninguna diferencia en las tasas de septicemia entre el grupo de intervención y el grupo de control (Prager 1984; Tuominen 1981). Sin embargo, estos estudios eran pequeños, presentaron algunas cuestiones metodológicas, y las pruebas que proporcionan no son concluyentes.
Basado en un único estudio (Vallés 2008), hubo tasas similares de mortalidad entre la solución basada en clorhexidina y la solución basada en povidona yodada. Sin embargo, los análisis tuvieron poco poder estadístico para establecer conclusiones clara con respecto a este resultado.
En el resultado de la colonización del catéter, existieron algunas diferencias entre los distintos regímenes de antisepsia de la piel; los regímenes que contenían clorhexidina parecieron ser más efectivos que los regímenes que contenían povidona yodada para reducir el riesgo.
Un ensayo mostró que la octenidina en alcohol pareció ser más efectiva que el alcohol solo para reducir la colonización del catéter. Tres estudios separados que compararon clorhexidina, povidona yodada y solución basada en alcohol, respectivamente, con ninguna antisepsia de la piel, no encontraron diferencias claras en las tasas de colonización del catéter entre el grupo de intervención y el grupo de control, aunque la cantidad de pruebas basado en estos estudios es insuficiente para extraer cualquier conclusión clara. El análisis basado en un número muy pequeño de estudios y catéteres indicó que una combinación de clorhexidina y povidona yodada pareció ser más efectiva que cualquiera de los agentes solos para reducir la colonización del catéter. Los análisis de los estudios únicos demostraron que no hubo diferencias claras en las tasas de infección del sitio de inserción, la colonización de la piel o los eventos adversos entre los diferentes regímenes de antisepsia de la piel examinados. En términos generales, los resultados de este metanálisis deben interpretarse con cuidado, debido a que la mayoría de los estudios incluidos no tuvo el poder estadístico suficiente para detectar una diferencia clara en los resultados, y algunos resultados significativos provinieron de estudios pequeños con fallas metodológicas, como lo mencionado anteriormente.
Compleción y aplicabilidad general de las pruebas
Se identificaron 13 estudios que cumplían con los criterios de selección en cuanto a la población, la intervención, la comparación y los resultados, y no hubo datos disponibles para el análisis en uno de cada 13 estudios. Se evaluó un total de 3446 catéteres. Los estudios tuvieron lugar en Europa, los EE.UU. y Asia, desde 1981 hasta 2013; en ámbitos en los que los CVC se usan comúnmente, como las UCI y las unidades de hematología y de oncología. Sin embargo, hay ciertas limitaciones en cuanto a la completitud de esta revisión. Por ejemplo, entre los participantes, los niños fueron sumamente subrepresentados y la mayoría de los estudios incluidos no evaluó de forma suficiente algunos de los resultados clave predeterminados de esta revisión, incluida la septicemia primaria, la mortalidad, los efectos adversos y los costos. Además, no fue posible realizar la mayoría de los análisis de subgrupos debido a que hubo datos insuficientes.
Calidad de la evidencia
En términos generales, la calidad de las pruebas para la mayoría de los resultados evaluados fue muy baja a moderada debido al número pequeño de estudios incluidos en cada comparación y al riesgo variable de sesgo de los estudios incluidos. Las pruebas más sólidas provienen de la comparación general entre las soluciones antisépticas que contienen clorhexidina versus las soluciones antisépticas que contienen povidona yodada, para las cuales se encontraron cinco estudios. Sin embargo, todas las comparaciones de esta revisión sufrieron de una falta de poder en el análisis, como lo demuestra el número pequeño de ensayos y catéteres en cada comparación. La falta de poder en el análisis ha afectado seriamente la confianza al interpretar los resultados en general, debido a que no fue posible determinar si los resultados estadísticamente no significativos eran indicativos de efectos ciertos (nulos) o de datos insuficientes para detectar diferencias. Además, en el caso de una diferencia estadísticamente significativa, un análisis con un número pequeño de ensayos y catéteres reduce la confiabilidad de los resultados debido a las inquietudes en cuanto a los efectos de los estudios pequeños en la exacerbación del impacto de los sesgos (Sterne 2011).
Una segunda limitación principal en la calidad de las pruebas recogidas fue el riesgo de sesgo de deserción, debido a que cuatro estudios presentaron un riesgo alto y tres un riesgo poco claro. En los estudios con alto riesgo de sesgo de deserción, los resultados agrupados variaron significativamente entre los escenarios del mejor y del peor de los casos y de los resultados reales presentados, lo cual dio lugar a que no fuese posible establecer una conclusión firme sobre los hallazgos de los resultados tratados. Además, la falta de cegamiento de los participantes en la mayoría de los estudios, así como las cuestiones relacionadas con la unidad de análisis en algunos estudios en los cuales los catéteres múltiples en los mismos participantes se analizaron como unidades separadas han afectado de forma adicional el rigor metodológico general de los estudios incluidos y a su vez la calidad de las pruebas. En términos generales, el grupo de pruebas recopiladas en esta revisión no permitió establecer una conclusión consistente con respecto a la efectividad y la seguridad de diversos regímenes de antisepsia de la piel en cuanto a la reducción de las infecciones relacionadas con el CVC (ver datos de resultados de las comparaciones principales de esta revisión en "Resumen de los hallazgos para la comparación principal").
Sesgos potenciales en el proceso de revisión
Se realizó una búsqueda exhaustiva de bases de datos múltiples con una detección, selección y evaluación independientes de los estudios aptos. Sin embargo, no se pudieron obtener todos los datos pertinentes; cinco estudios están en espera de evaluación, ya que había dificultades para obtener los textos completos, y otro es un estudio en curso. Muchos de los estudios excluidos evaluaron una combinación de catéteres arteriales y venosos aunque no informaron datos de resultado por separado para el CVC, lo cual impidió la inclusión de mucha información potencialmente relevante. Actualmente se está esperando que los autores de los estudios involucrados proporcionen datos relevantes para las actualizaciones futuras.
Hay algunas cuestiones no resueltas en cuanto a la unidad de análisis en esta revisión: para los resultados específicos del catéter como la septicemia relacionada con el catéter y la colonización del catéter, los resultados se presentaron de la misma manera que los estudios originales, utilizando los catéteres en lugar de los participantes como la unidad del análisis. Como resultado, la revisión incluyó catéteres múltiples en los mismos participantes. El fracaso en cuanto a las cuestiones del ajuste para esta unidad de análisis podría haber afectado los resultados.
Acuerdos y desacuerdos con otros estudios o revisiones
Los resultados de esta revisión están ampliamente de acuerdo con otras dos revisiones sobre este tema (Adams 2007; Chaiyakunapruk 2002), que establecieron la conclusión de que las soluciones antisépticas que contienen clorhexidina son más efectivas que las que contienen povidona yodada para reducir la colonización del catéter y la septicemia relacionada con el catéter. De las dos revisiones, Adams 2007 fue una revisión narrativa y Chaiyakunapruk 2002 fue una revisión sistemática que evaluó la clorhexidina versus povidona yodada en todos los catéteres vasculares, incluidos los catéteres venosos arteriales, centrales y periféricos. Chaiyakunapruk 2002 indicó que las soluciones antisépticas que contenían clorhexidina redujeron la septicemia relacionada con el catéter en un 49% en promedio, en comparación con povidona yodada, aunque hubo un gran nivel de incertidumbre en cuanto a la magnitud del beneficio, según lo refleja un intervalo de confianza amplio (CR 0,51; IC 0,27 a 0,97; 8 ECA incluidos, tres que evaluaron sólo CVC, 4143 catéteres arteriales y venosos combinados que incluían 1493 CVC). La revisión, que se centra sólo en los catéteres venosos centrales, incluyó dos ensayos más aunque un número algo más pequeño de CVC, y se observó que una solución que contenía clorhexidina redujo la septicemia relacionada con el catéter en un promedio de 36% (efecto relativo) en comparación con povidona yodada (CR 0,64; IC 0,41 a 0,99; 5 estudios, 1436 CVC).

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Forest plot of comparison: 1 Chlorhexidine versus povidone‐iodine, outcome: 1.1 Catheter‐related BSI.

Forest plot of comparison: 1 Chlorhexidine versus povidone‐iodine, outcome: 1.3 All‐cause mortality.

Forest plot of comparison: 1 Chlorhexidine versus povidone‐iodine, outcome: 1.4 Catheter colonisation.
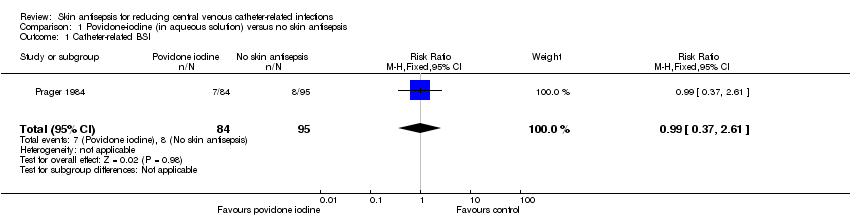
Comparison 1 Povidone‐iodine (in aqueous solution) versus no skin antisepsis, Outcome 1 Catheter‐related BSI.
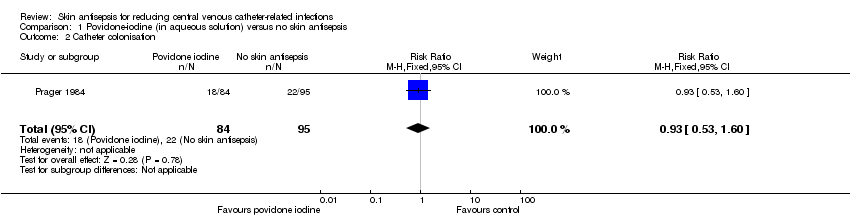
Comparison 1 Povidone‐iodine (in aqueous solution) versus no skin antisepsis, Outcome 2 Catheter colonisation.
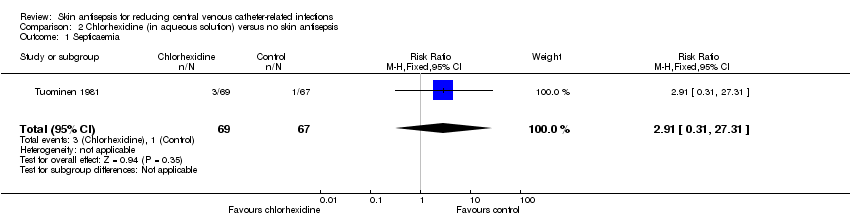
Comparison 2 Chlorhexidine (in aqueous solution) versus no skin antisepsis, Outcome 1 Septicaemia.

Comparison 2 Chlorhexidine (in aqueous solution) versus no skin antisepsis, Outcome 2 Catheter colonisation.

Comparison 2 Chlorhexidine (in aqueous solution) versus no skin antisepsis, Outcome 3 Number of patients who required antibiotics during in‐dwelling period of catheter.
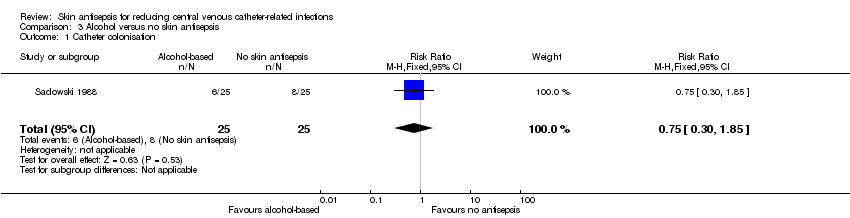
Comparison 3 Alcohol versus no skin antisepsis, Outcome 1 Catheter colonisation.

Comparison 4 Chlorhexidine versus povidone‐iodine, Outcome 1 Catheter‐related BSI.

Comparison 4 Chlorhexidine versus povidone‐iodine, Outcome 2 Catheter‐related BSI per 1000 catheter‐days.
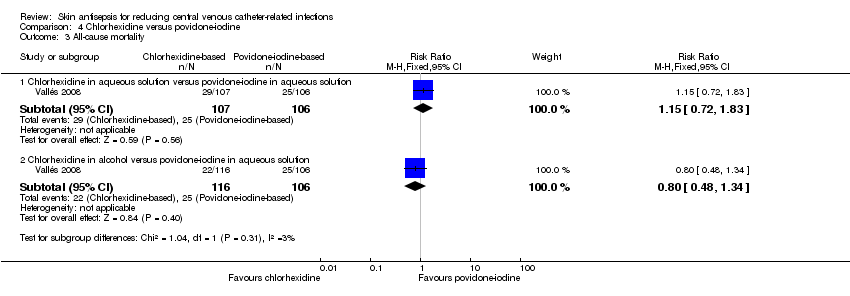
Comparison 4 Chlorhexidine versus povidone‐iodine, Outcome 3 All‐cause mortality.

Comparison 4 Chlorhexidine versus povidone‐iodine, Outcome 4 Catheter colonisation.

Comparison 4 Chlorhexidine versus povidone‐iodine, Outcome 5 Catheter colonisation per 1000 catheter‐days.

Comparison 4 Chlorhexidine versus povidone‐iodine, Outcome 6 Insertion site infection.

Comparison 5 Chlorhexidine (in aqueous solution) versus alcohol, Outcome 1 Catheter‐related BSI.
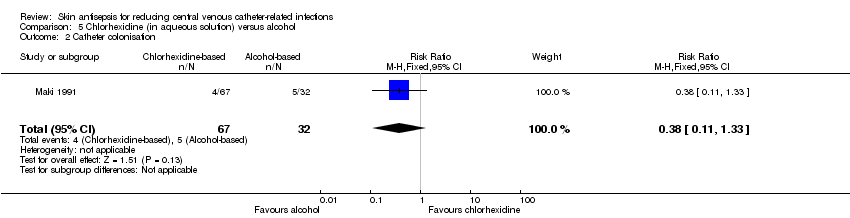
Comparison 5 Chlorhexidine (in aqueous solution) versus alcohol, Outcome 2 Catheter colonisation.
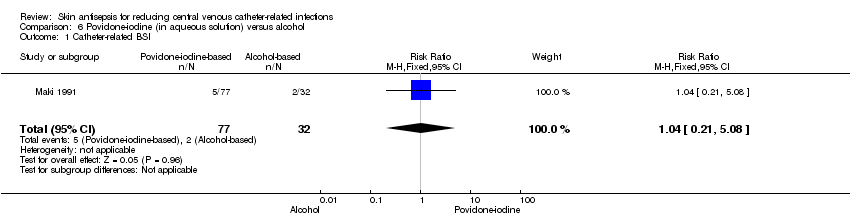
Comparison 6 Povidone‐iodine (in aqueous solution) versus alcohol, Outcome 1 Catheter‐related BSI.
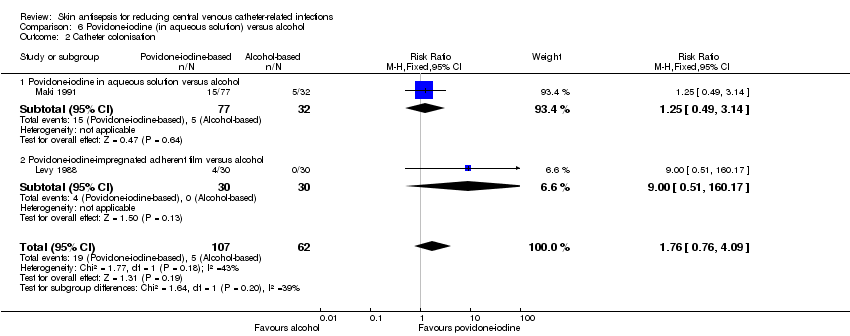
Comparison 6 Povidone‐iodine (in aqueous solution) versus alcohol, Outcome 2 Catheter colonisation.

Comparison 7 Alcohol versus octenidine in alcohol, Outcome 1 Catheter‐related BSI.

Comparison 7 Alcohol versus octenidine in alcohol, Outcome 2 Catheter‐related BSI per 1000 catheter‐days.

Comparison 7 Alcohol versus octenidine in alcohol, Outcome 3 Catheter colonisation.

Comparison 7 Alcohol versus octenidine in alcohol, Outcome 4 Catheter colonisation per 1000 catheter‐days.

Comparison 7 Alcohol versus octenidine in alcohol, Outcome 5 Skin colonisation.

Comparison 7 Alcohol versus octenidine in alcohol, Outcome 6 Adverse effects.
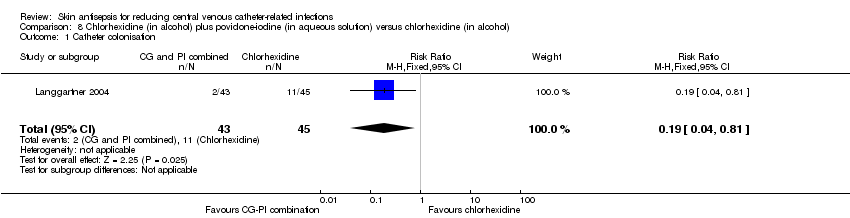
Comparison 8 Chlorhexidine (in alcohol) plus povidone‐iodine (in aqueous solution) versus chlorhexidine (in alcohol), Outcome 1 Catheter colonisation.
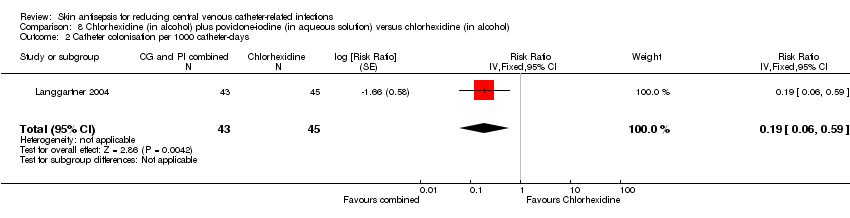
Comparison 8 Chlorhexidine (in alcohol) plus povidone‐iodine (in aqueous solution) versus chlorhexidine (in alcohol), Outcome 2 Catheter colonisation per 1000 catheter‐days.

Comparison 9 Chlorhexidine (in alcohol) plus povidone‐iodine (in aqueous solution) versus povidone‐iodine (in aqueous solution), Outcome 1 Catheter colonisation.

Comparison 9 Chlorhexidine (in alcohol) plus povidone‐iodine (in aqueous solution) versus povidone‐iodine (in aqueous solution), Outcome 2 Catheter colonisation per 1000 catheter‐days.
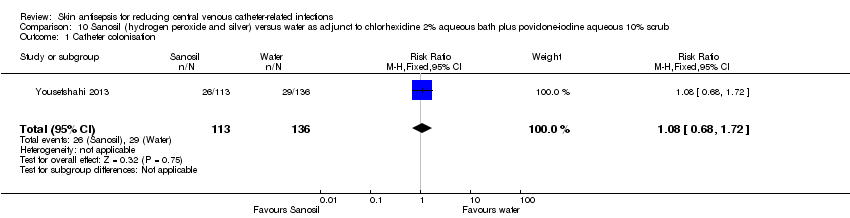
Comparison 10 Sanosil (hydrogen peroxide and silver) versus water as adjunct to chlorhexidine 2% aqueous bath plus povidone‐iodine aqueous 10% scrub, Outcome 1 Catheter colonisation.
| Chlorhexidine compared to povidone‐iodine for patients with a central venous catheter | |||||
| Patient or population: patients with a central venous catheter | |||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No. of Participants | Quality of the evidence | |
| Assumed risk | Corresponding risk | ||||
| Povidone‐iodine | Chlorhexidine | ||||
| Catheter‐related BSI ‐ overall comparison between chlorhexidine and povidone‐iodine (during in‐patient stay) | Study population | RR 0.64 | 1436 | ⊕⊝⊝⊝ | |
| 64 per 1000 | 41 per 1000 | ||||
| Moderatea | |||||
| 46 per 1000 | 29 per 1000 | ||||
| Catheter‐related BSI ‐ subgroup: chlorhexidine in aqueous solution versus povidone‐iodine in aqueous solution | Study population | RR 0.64 | 452 | ⊕⊝⊝⊝ | |
| 86 per 1000 | 55 per 1000 | ||||
| Moderate | |||||
| 84 per 1000 | 54 per 1000 | ||||
| Catheter‐related BSI ‐ subgroup: chlorhexidine in alcohol versus povidone‐iodine in aqueous solution | Study population | RR 0.77 | 503 | ⊕⊝⊝⊝ | |
| 70 per 1000 | 54 per 1000 | ||||
| Moderate | |||||
| 69 per 1000 | 53 per 1000 | ||||
| Catheter‐related BSI ‐ subgroup: chlorhexidine in alcohol versus povidone‐iodine in alcohol | Study population | RR 0.4 | 481 | ⊕⊕⊕⊝ | |
| 42 per 1000 | 17 per 1000 | ||||
| Moderate | |||||
| 42 per 1000 | 17 per 1000 | ||||
| Primary BSI or clinical sepsis | No studies under this comparison assessed this outcome. | ||||
| All‐cause mortality ‐ Chlorhexidine in aqueous solution versus povidone‐iodine in aqueous solution | Study population | RR 1.15 | 213 | ⊕⊕⊝⊝ | |
| 236 per 1000 | 271 per 1000 | ||||
| Moderate | |||||
| 236 per 1000 | 271 per 1000 | ||||
| All‐cause mortality ‐ Chlorhexidine in alcohol versus povidone‐iodine in aqueous solution | Study population | RR 0.8 | 222 | ⊕⊕⊝⊝ | |
| 236 per 1000 | 189 per 1000 | ||||
| Moderate | |||||
| 236 per 1000 | 189 per 1000 | ||||
| Mortality attributable the CVC‐related infections. | No studies under this comparison assessed this outcome. | ||||
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence | |||||
| a'Moderate risk' was calculated from the median control event rate for each outcome. | |||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Catheter‐related BSI Show forest plot | 1 | 179 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.99 [0.37, 2.61] |
| 2 Catheter colonisation Show forest plot | 1 | 179 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.93 [0.53, 1.60] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Septicaemia Show forest plot | 1 | 136 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.91 [0.31, 27.31] |
| 2 Catheter colonisation Show forest plot | 1 | 124 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.26 [0.61, 2.59] |
| 3 Number of patients who required antibiotics during in‐dwelling period of catheter Show forest plot | 1 | 136 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.84 [0.55, 1.27] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Catheter colonisation Show forest plot | 1 | 50 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.75 [0.30, 1.85] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Catheter‐related BSI Show forest plot | 4 | 1436 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.64 [0.41, 0.99] |
| 1.1 Chlorhexidine in aqueous solution versus povidone‐iodine in aqueous solution | 2 | 452 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.64 [0.32, 1.28] |
| 1.2 Chlorhexidine in alcohol versus povidone‐iodine in aqueous solution | 2 | 503 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.77 [0.39, 1.53] |
| 1.3 Chlorhexidine in alcohol versus povidone‐iodine in alcohol | 1 | 481 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.40 [0.13, 1.24] |
| 2 Catheter‐related BSI per 1000 catheter‐days Show forest plot | 4 | 1450 | Risk Ratio (Fixed, 95% CI) | 0.53 [0.30, 0.94] |
| 2.1 Chlorhexidine in aqueous solution versus povidone‐iodine in aqueous solution | 1 | 308 | Risk Ratio (Fixed, 95% CI) | 0.82 [0.23, 2.93] |
| 2.2 Chlorhexidine in alcohol versus povidone‐iodine in aqueous solution | 3 | 661 | Risk Ratio (Fixed, 95% CI) | 0.49 [0.25, 0.95] |
| 2.3 Chlorhexidine in alcohol versus povidone‐iodine in alcohol | 1 | 481 | Risk Ratio (Fixed, 95% CI) | 0.41 [0.06, 2.92] |
| 3 All‐cause mortality Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Subtotals only | |
| 3.1 Chlorhexidine in aqueous solution versus povidone‐iodine in aqueous solution | 1 | 213 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.15 [0.72, 1.83] |
| 3.2 Chlorhexidine in alcohol versus povidone‐iodine in aqueous solution | 1 | 222 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.80 [0.48, 1.34] |
| 4 Catheter colonisation Show forest plot | 5 | 1533 | Risk Difference (M‐H, Fixed, 95% CI) | ‐0.08 [‐0.12, ‐0.03] |
| 4.1 Chlorhexidine in aqueous solution versus povidone‐iodine in aqueous solution | 2 | 452 | Risk Difference (M‐H, Fixed, 95% CI) | ‐0.09 [‐0.17, ‐0.02] |
| 4.2 Chlorhexidine in alcohol versus povidone‐iodine in aqueous solution | 3 | 600 | Risk Difference (M‐H, Fixed, 95% CI) | ‐0.04 [‐0.11, 0.03] |
| 4.3 Chlorhexidine in alcohol versus povidone‐iodine in alcohol | 1 | 481 | Risk Difference (M‐H, Fixed, 95% CI) | ‐0.11 [‐0.17, ‐0.04] |
| 5 Catheter colonisation per 1000 catheter‐days Show forest plot | 5 | 1547 | Risk Ratio (Fixed, 95% CI) | 0.64 [0.50, 0.81] |
| 5.1 Chlorhexidine in aqueous solution versus povidone‐iodine in aqueous solution | 1 | 308 | Risk Ratio (Fixed, 95% CI) | 0.69 [0.40, 1.20] |
| 5.2 Chlorhexidine in alcohol versus povidone‐iodine in aqueous solution | 4 | 758 | Risk Ratio (Fixed, 95% CI) | 0.64 [0.48, 0.85] |
| 5.3 Chlorhexidine in alcohol versus povidone‐iodine in alcohol | 1 | 481 | Risk Ratio (Fixed, 95% CI) | 0.53 [0.24, 1.17] |
| 6 Insertion site infection Show forest plot | 1 | 242 | Mean Difference (IV, Fixed, 95% CI) | ‐2.80 [‐9.10, 3.50] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Catheter‐related BSI Show forest plot | 1 | 99 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.24 [0.02, 2.54] |
| 2 Catheter colonisation Show forest plot | 1 | 99 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.38 [0.11, 1.33] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Catheter‐related BSI Show forest plot | 1 | 109 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.04 [0.21, 5.08] |
| 2 Catheter colonisation Show forest plot | 2 | 169 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.76 [0.76, 4.09] |
| 2.1 Povidone‐iodine in aqueous solution versus alcohol | 1 | 109 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.25 [0.49, 3.14] |
| 2.2 Povidone‐iodine‐impregnated adherent film versus alcohol | 1 | 60 | Risk Ratio (M‐H, Fixed, 95% CI) | 9.0 [0.51, 160.17] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Catheter‐related BSI Show forest plot | 1 | 387 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.01 [0.88, 4.59] |
| 2 Catheter‐related BSI per 1000 catheter‐days Show forest plot | 1 | 387 | Risk Ratio (Fixed, 95% CI) | 2.18 [0.54, 8.77] |
| 3 Catheter colonisation Show forest plot | 1 | 322 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.26 [1.22, 4.21] |
| 4 Catheter colonisation per 1000 catheter‐days Show forest plot | 1 | 322 | Risk Ratio (Fixed, 95% CI) | 2.23 [0.79, 6.29] |
| 5 Skin colonisation Show forest plot | 1 | 365 | Mean Difference (IV, Fixed, 95% CI) | 79.00 [32.76, 125.24] |
| 6 Adverse effects Show forest plot | 1 | 398 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.85 [0.60, 1.20] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Catheter colonisation Show forest plot | 1 | 88 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.19 [0.04, 0.81] |
| 2 Catheter colonisation per 1000 catheter‐days Show forest plot | 1 | 88 | Risk Ratio (Fixed, 95% CI) | 0.19 [0.06, 0.59] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Catheter colonisation Show forest plot | 1 | 95 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.15 [0.04, 0.62] |
| 2 Catheter colonisation per 1000 catheter‐days Show forest plot | 1 | 95 | Risk Ratio (Fixed, 95% CI) | 0.17 [0.05, 0.52] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Catheter colonisation Show forest plot | 1 | 249 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.08 [0.68, 1.72] |

