Intervenciones para el tratamiento de la enfermedad de las alturas aguda
Resumen
Antecedentes
La enfermedad de las alturas aguda se define como un grupo de síndromes cerebrales y pulmonares que pueden ocurrir durante el viaje a grandes alturas. Es más frecuente por encima de los 2500 metros, pero se puede observar a alturas inferiores, especialmente en los pacientes susceptibles. La enfermedad de las alturas aguda incluye un espectro amplio de síndromes definidos bajo los términos "mal de montaña agudo" (MMA), "edema cerebral de las alturas" y "edema pulmonar de las alturas". Hay varias intervenciones farmacológicas y no farmacológicas disponibles para tratar esta afección; sin embargo, hay una gran incertidumbre con respecto a sus efectos beneficiosos y perjudiciales.
Objetivos
Evaluar la efectividad clínica y la seguridad de las intervenciones (no farmacológicas y farmacológicas), como monoterapia o en cualquier combinación, para el tratamiento de la enfermedad de las alturas aguda.
Métodos de búsqueda
Se hicieron búsquedas de estudios en curso en CENTRAL, MEDLINE, Embase, LILACS, ISI Web of Science, CINAHL, en la Wanfang database y en la World Health Organization International Clinical Trials Registry Platform el 10 agosto 2017. No se aplicaron restricciones de idioma.
Criterios de selección
Se incluyeron los ensayos controlados aleatorios que evaluaron los efectos de las intervenciones farmacológicas y no farmacológicas para los individuos que presentaron enfermedad de las alturas aguda: mal de montaña agudo, edema pulmonar de las alturas o edema cerebral de las alturas.
Obtención y análisis de los datos
Dos autores de la revisión evaluaron de manera independiente la elegibilidad de los informes de los estudios y el riesgo de sesgo de cada uno, y realizaron la extracción de los datos. Los desacuerdos se resolvieron mediante discusión con un tercer autor de la revisión. Se evaluó la calidad de la evidencia con GRADE.
Resultados principales
Se incluyeron 13 estudios con un total de 468 participantes. Se identificaron dos estudios en curso. Todos los estudios incluyeron adultos, y dos estudios incluyeron tanto adolescentes como adultos. Los 13 estudios se realizaron en áreas de gran altitud, principalmente en los Alpes europeos. Doce estudios incluyeron participantes con mal de montaña agudo, y un estudio incluyó participantes con edema pulmonar de las alturas agudo. El seguimiento fue generalmente menor de un día. La calidad de la evidencia en la mayoría de los casos se disminuyó debido al riesgo de sesgo y la imprecisión. Los resultados para las comparaciones principales se presentan de la manera siguiente.
Intervenciones no farmacológicas (tres estudios, 124 participantes)
Ninguno de los tres ensayos incluidos informó la mortalidad por cualquier causa ni el alivio completo de los síntomas del MMA. Un estudio con 64 participantes encontró que el descenso simulado de 193 milibares versus 20 milibares puede reducir el promedio de síntomas a 2,5 versus 3,1 unidades después de 12 horas de tratamiento (la puntuación clínica varió de 0 a 11 [peor]; reducción de 0,6 puntos como promedio con la intervención; evidencia de baja calidad). Además, no se encontraron complicaciones con el uso de la cámara hiperbárica versus el oxígeno complementario (un estudio; 29 participantes; evidencia de baja calidad).
Intervenciones farmacológicas (11 ensayos, 375 participantes)
Ninguno de los 11 ensayos incluidos informó la mortalidad por cualquier causa. Un ensayo encontró una mayor proporción de participantes con alivio completo de los síntomas del MMA después de 12 y 16 horas de administrada la dexametasona en comparación con placebo (47,1% versus 0%, respectivamente; un estudio; 35 participantes; evidencia de baja calidad). Asimismo, cuando la acetazolamida se comparó con placebo, los efectos sobre la gravedad de los síntomas no fueron claros (diferencia de medias estandarizada [DME] −1,15; IC del 95% −2,56 a 0,27; dos estudios, 25 participantes; evidencia de baja calidad). Un ensayo de dexametasona comparada con placebo en 35 participantes encontró una reducción en la gravedad de los síntomas (diferencia en el cambio en la puntuación de MMA: 3,7 unidades informadas por los autores; evidencia de calidad moderada). Los efectos de dos ensayos adicionales que compararon la gabapentina con placebo y el magnesio con placebo con respecto a la gravedad de los síntomas al final del tratamiento fueron poco claros. Para gabapentina versus placebo: media de las puntuaciones 2,92 versus 4,75 respectivamente, en la escala analógica visual (EAV) 24 participantes; evidencia de baja calidad. Para magnesio versus placebo: media de las puntuaciones 9 y 10,3 unidades, respectivamente; 25 participantes; evidencia de baja calidad). Los ensayos no encontraron eventos adversos con cualquiera de los tratamientos (evidencia de baja calidad). Un ensayo que comparó el sulfato de magnesio versus placebo encontró que el rubor fue un evento frecuente en el brazo de sulfato de magnesio (porcentaje de rubor: 75% versus 7,7%, respectivamente; un estudio; 25 participantes; evidencia de baja calidad).
Conclusiones de los autores
Hay evidencia disponible limitada para determinar los efectos de las intervenciones farmacológicas y no farmacológicas sobre el tratamiento de la enfermedad de las alturas aguda. La evidencia de baja calidad indica que la dexametasona y la acetazolamida podrían reducir la puntuación del MMA en comparación con placebo. Sin embargo, los efectos beneficiosos y perjudiciales clínicos relacionados con estas posibles intervenciones aún son poco claros. En términos generales, la evidencia es de importancia práctica limitada en el campo clínico. Se necesitan estudios de investigación de alta calidad en este campo, ya que la mayoría de los ensayos se realizaron e informaron de manera deficiente.
PICOs
Resumen en términos sencillos
Tratamientos para la enfermedad de las alturas (mal de montaña)
Antecedentes
La enfermedad de las alturas aguda, también conocida como mal de montaña agudo, puede presentarse con diversos síntomas. Es causada por la disminución del nivel de oxígeno a alturas cada vez mayores; y se puede experimentar cuando se alcanza una gran altura al viajar, caminar o escalar montañas u otras áreas elevadas. Las personas que viajan a alturas por encima de los 4000 metros, las mujeres, las personas que no han alcanzado la edad adulta media, y las personas con antecedentes de migraña tienen un riesgo mayor de presentar enfermedad de las alturas. Los síntomas más frecuentes son cefalea, pérdida del apetito, insomnio y náuseas. Sin embargo, las formas graves pueden incluir confusión, dificultad para caminar, tos progresiva, disnea, e incluso la muerte.
Pregunta de la revisión
¿Cuáles son los efectos beneficiosos y los riesgos de los diferentes tratamientos para los pacientes que presentan enfermedad de las alturas?
Características de los estudios
Se incluyeron 13 estudios con un total de 468 participantes. La mayoría de los estudios incluyeron participantes con formas leves o moderadas de mal de montaña, y solo un estudio incluyó la forma grave neurológica (trastornos del sistema nervioso). El seguimiento fue generalmente menor de un día. También se identificaron dos estudios en curso.
Resultados clave
Se encontraron estudios que evaluaban las siguientes intervenciones: descenso simulado con una cámara hiperbárica (uso médico de oxígeno en una cámara especial a una presión mayor que la atmosférica para aumentar la disponibilidad de oxígeno en el cuerpo); oxígeno; fármacos: acetazolamida, dexametasona, ibuprofeno, paracetamol, gabapentina, sumatriptán, óxido nítrico y sulfato de magnesio. Ninguno de los estudios informó los efectos de estas intervenciones en la mortalidad por cualquier las causa. El informe del alivio completo de los síntomas del mal de montaña agudo, así como los eventos adversos, fueron poco frecuentes. Los estudios relacionados con el descenso simulado con uso de una cámara hiperbárica no encontraron efectos beneficiosos ni perjudiciales adicionales relacionados con esta intervención (tres estudios, 124 participantes). Además, los estudios relacionados con la administración de fármacos encontraron algunos efectos beneficiosos en cuanto a la reducción de los síntomas con la administración de acetazolamida (dos estudios, 25 participantes) y dexametasona (un estudio, 35 participantes), sin un aumento de los efectos secundarios.
Calidad de la evidencia
Se encontró que la calidad de la evidencia fue baja, por lo que la certeza en los hallazgos es limitada. No hubo información suficiente sobre cómo se realizaron los estudios y en algunos casos hubo evidencia de manipulación en algunos estadios de los ensayos. Además, el número de pacientes en cada estudio fue muy pequeño (< 30 participantes), por lo que los resultados no fueron claros (imprecisos). Algunos estudios no se cegaron (o sea, los participantes sabían qué tratamiento experimental recibían), lo que podría haber afectado la manera en la que los participantes evaluaron sus propios síntomas.
Conclusiones de los autores
Summary of findings
| Non‐pharmacological interventions for treating acute high altitude illness | ||||||
| Patient or population: people suffering from high altitude illness | ||||||
| Outcomes and intervention | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with various interventions | Risk with non‐pharmacological interventions | |||||
| All‐cause mortality | ‐ | ‐ | ‐ | ‐ | ‐ | Not reported |
| Complete relief of AMS symptoms | ‐ | ‐ | ‐ | ‐ | ‐ | Not reported |
| Reduction in symptom score severity at 12 hours (Clinical score: ranged from 0 to 11 (worse)) Intervention: Simulated descent of 193 millibars versus 20 millibars | The mean score in the control group was 3.1 | The mean score in the intervention group was 2.5 | 0.6 points lower with intervention | 64 (1 RCT) | ⊕⊕⊝⊝ | |
| Adverse effects during treatment Intervention: Hyperbaric chamber/ 160 millibars versus supplementary oxygen | 0 per 1000 | 0 per 1000 | Nil | 29 | ⊕⊕⊝⊝ | |
| *The risk in the intervention group (and its 95% CI) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Quality of evidence downgraded by two levels due to serious risk of bias (performance bias (blinding was not specified), attrition bias and selective reporting bias) and serious imprecision (optimal information size criteria not achieved) | ||||||
| Pharmacological interventions for treating acute high altitude illness | |||||||
| Patient or population: people suffering from high altitude illness | |||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | ||
| Risk with various interventions | Risk with pharmacological interventions | ||||||
| All‐cause mortality | ‐ | ‐ | ‐ | ‐ | ‐ | Not reported | |
| Complete relief of AMS symptoms (12 to 16 hours after treatment) Scale used: Acute Mountain Sickness score (ranged from 0 to 9 (worse)) | Dexamethasone versus placebo | 0 per 1000 | 471 per 1000 | No estimable | 35 | ⊕⊕⊝⊝ | |
| Reduction in symptom score severity Time of measurement: 1 to 48 hours after treatment, end of treatment Scale of measurement: Self‐administered AMS questionnaires (ranged from 0 to 90 (worse)), AMS Symptom Questionnaire (ranged from 0 to 22 (worse)), Acute Mountain Sickness score (ranged from 0 to 9 (worse)), HAH Visual analogue score (VAS) (range no stated), Lake Louise Score (from 0 to 15 (worse)), | Acetazolamide versus placebo | Standardized Mean Difference 1.15 lower | 25 | ⊕⊕⊝⊝ | |||
| Dexamethasone versus placebo | Mean change from baseline: 0.4 units | Mean change from baseline: 4.1 units | Difference of 3.7 units (reported by trial authors) | 35 | ⊕⊕⊕⊝ | ||
| Gabapentin versus placebo | Mean VAS score: 4.75 | Mean VAS score: 2.92 | Not stated | 24 | ⊕⊕⊝⊝ | ||
| Magnesium versus placebo | Mean score: 10.3 units | Mean score: 9 units | Not stated | 25 | ⊕⊕⊝⊝ | ||
| Adverse effects Time of measurement: 1 to 48 hours after treatment, end of treatment Scale of measurement:not stated | Acetazolamide versus placebo | No reported | 0 per 1000 | Not estimable | 25 | ⊕⊕⊝⊝ | |
| Gabapentin versus placebo | 0 per 1000 | 0 per 1000 | Not stated | 24 | ⊕⊕⊝⊝ | ||
| Magnesium sulphate versus placebo | 77 per 1000 | 750 per 1000 | Not stated | 25 | ⊕⊕⊝⊝ | ||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||||
| GRADE Working Group grades of evidence | |||||||
| 1 Quality of evidence downgraded by two levels due to very serious risk of bias (multiple unclear biases and high risk of selective reporting bias) 2 Quality of evidence downgraded by two levels due to serious risk of bias (selection bias) and serious inconsistency (I² = 58%). 3 Quality of evidence downgraded by one level due to serious risk of bias (selection, performance and detection bias). 4 Quality of evidence downgraded by two levels due to serious risk of bias and serious imprecision. | |||||||
Antecedentes
Las alturas se clasifican de manera arbitraria como grandes (1500 a 3500 metros), muy grandes (3500 a 5500 metros) y extremas (por encima de los 5500 metros) (Paralikar 2010). A grandes alturas hay una disminución en la presión barométrica, lo que provoca una disminución en la presión parcial de oxígeno. En la mayoría de los casos, esta hipoxia hipobárica desencadena respuestas fisiológicas que ayudan al individuo a que tolere y se adapte a las condiciones de oxígeno bajo. Sin embargo, en otros casos hay respuestas anormales, lo que a su vez causa una de las tres formas de la enfermedad de las alturas aguda: mal de montaña agudo (MMA), edema cerebral de las alturas (HACE, por sus siglas en inglés) y edema pulmonar de las alturas (HAPE, por sus siglas en inglés) (Luks 2017).
La enfermedad de las alturas aguda es más frecuente por encima de los 2500 metros, pero se puede observar a elevaciones inferiores, especialmente en los pacientes susceptibles. Factores como la tasa de ascenso, el cambio absoluto en la altitud y la fisiología individual son determinantes primarios de si se desarrollará o no la enfermedad de las alturas (Palmer 2010). Las personas que viajan a altitudes por encima de los 4000 metros, las mujeres, las personas que no han alcanzado la edad adulta media, y las personas con antecedentes de migraña tienen un riesgo mayor de presentar enfermedad de las alturas (Bärtsch 2013; Canoui‐Poitrine 2014).
Descripción de la afección
Enfermedad de las alturas (HAI, por sus siglas en inglés)
Los posibles problemas médicos asociados con una excursión a grandes alturas son muchos, y en ocasiones la terminología ha confundido su clasificación. Para esta revisión, la enfermedad de las alturas (HAI) se define como un grupo de síndromes cerebrales y pulmonares que pueden ocurrir durante el viaje a elevaciones por encima de los 2500 metros (Luks 2014). Lo anterior incluye síndromes incluidos bajo los términos "mal de montaña agudo" (MMA), edema cerebral de las alturas" (HACE, por sus siglas en inglés), y "edema pulmonar de las alturas" (HAPE, por sus siglas en inglés). Las categorías de riesgo para el mal de montaña agudo se muestran en el Apéndice 1 (Luks 2010; Luks 2014). La HAI se considera una causa importante de mortalidad en la montaña (Windsor 2009).
Otros problemas médicos que se pueden encontrar en las alturas incluyen hipoxia aguda, síndromes cerebrovasculares, edema periférico, retinopatía, hemorragia retiniana, tromboembolia, trastornos del sueño y respiración periódica, faringitis y bronquitis de las alturas, exposición a los rayos ultravioleta y queratitis (ceguera de la nieve) y exacerbación de enfermedades preexistentes (CATMAT 2007; Palmer 2010; Schoene 2008); sin embargo, dichos problemas no se considerarán en esta revisión.
Mal de montaña agudo (MMA) y edema cerebral de las alturas (HACE)
El MMA es un trastorno neurológico caracterizado por cefalea, anorexia, náuseas y en ocasiones vómitos, mareo, insomnio y fatiga o pérdida de la energía (Palmer 2010). La cefalea es el síntoma más prevalente (Luks 2017). Por el contrario, el HACE es un trastorno neurológico potencialmente mortal que se caracteriza por alteración de la conciencia o ataxia (Imray 2010), o ambas. Si no se trata, el HACE puede dar lugar a la muerte posterior a herniación cerebral (Bailey 2009). El HACE se considera ampliamente como el estadio final del MMA y por lo general está precedido por síntomas de MMA (Basnyat 2003), lo que indica que son resultado de un proceso fisiopatológico similar (Palmer 2010). Ambos síndromes se caracterizan por tumefacción cerebral edematosa e hipertensión intracraneal (Luks 2017). La gravedad del MMA se puede calificar mediante el Lake Louise Questionnaire, el Environmental Symptoms Questionnaire, o mediante el uso de una escala analógica sencilla (Imray 2010).
La fisiopatología incluye aparentemente una interacción de múltiples respuestas fisiológicas a la hipoxia (ventilación, vasculatura cerebral, sistema nervioso autonómico y umbrales nociceptivos), y factores anatómicos como la capacidad compensadora del líquido cefalorraquídeo y la capacidad de salida del flujo venoso (Luks 2017).
Edema pulmonar de las alturas (HAPE)
El HAPE es un edema pulmonar no cardiogénico (Smedley 2013). Se caracteriza por tos, disnea progresiva con el esfuerzo y reducción de la tolerancia al ejercicio, y en general se desarrolla de dos a cuatro días después de llegar a las alturas (Hall 2011). El HAPE es poco frecuente después de una semana de la aclimatación a una altitud particular (Maggiorini 2010; Palmer 2010). La hipoxia es el factor desencadenante que da lugar a una cascada compleja de eventos que dan lugar al HAPE (Stream 2008). Esencialmente, el HAPE se debe a un "desequilibrio persistente entre las fuerzas que llevan el agua hacia el espacio aéreo y los mecanismos biológicos para su extracción" (Scherrer 2010). El sello distintivo de esta afección es la hipertensión pulmonar hipóxica, que puede estar mediada por al menos tres mecanismos posibles: síntesis defectuosa de óxido nítrico pulmonar; síntesis exagerada de endotelina‐1; y activación simpática exagerada (Scherrer 2010). También se ha indicado un defecto en el transporte transepitelial alveolar de sodio (Scherrer 2010). Una revisión amplia de la hipertensión pulmonar inducida por las alturas se informa en Pasha 2010.
Epidemiología de la enfermedad de las alturas aguda (HAI)
Se ha calculado que el 25% de las personas a una altitud moderada presentan mal de montaña agudo (MMA), así como del 50% al 85% de los viajeros que alcanzan los 4000 metros o más (Eide 2012). La incidencia de edema cerebral de las alturas y edema pulmonar de las alturas es mucho menor que la del MMA, y se calcula en el rango del 0,1% al 4,0% (Luks 2010). El ascenso rápido, la aclimatación deficiente, el esfuerzo físico en las alturas, las edades más jóvenes y los antecedentes de enfermedad de las alturas son los principales factores de riesgo para desarrollar la HAI (Eide 2012). Otros factores de riesgo son residencia permanente por debajo de 900 metros; obesidad (Ri‐Li 2003); y cardiopatía coronaria (Dehnert 2010).
(Ver Apéndice 2 para el glosario de términos médicos.)
Descripción de la intervención
Las intervenciones para el tratamiento de la HAI se pueden clasificar de una manera amplia en farmacológicos y no farmacológicos. Se han publicado varias declaraciones de consenso y guías en esta área. Algunas de ellas han sido publicadas por la Wilderness Medical Society (Luks 2014); la declaración del Committee to Advise on Tropical Medicine and Travel (CATMAT 2007); y los Centers for Disease Control and Prevention (CDC; CDC Yellow Book 2016).
A) Intervenciones no farmacológicas
-
Descenso (Hackett 2004)
-
Cámara hiperbárica (Bärtsch 1993; Kasic 1991; Keller 1995)
-
Bolsa a presión portátil o bolsa de Gamow (Austin 1998; Freeman 2004; Zafren 1998)
-
Sistema respiratorio diseñado para conservar el aporte de oxígeno en la altura (Pattinson 2005)
-
Presión positiva de las vías respiratorias y otros tratamientos (Koch 2009; Schoene 1985)
B) Intervenciones farmacológicas
-
Oxígeno (Hill 1909; Zafren 1996)
-
Inhibidores de anhidrasa carbónica: acetazolamida (Grissom 1992)
-
Glucocorticosteroides: dexametasona (Ferrazzini 1987; Hackett 1988; Hackett 2004; Levine 1989; Wright 2008); medroxiprogesterona (Wright 2008)
-
Fármacos antiinflamatorios no esteroides (NSAIDs): ibuprofeno (Broome 1994; Harris 2003); paracetamol (Harris 2003); y aspirina (Burtscher 2001)
-
Agonista selectivo de receptores de 5‐hidroxitriptamina (1): sumatriptán (Utiger 2002)
-
Óxido nítrico inhalado (Scherrer 1996; Schoene 2004)
-
Fármacos anticonvulsivos: gabapentina (Jafarian 2007a)
-
Diuréticos: furosemida (Hultgren 1975)
-
Bloqueadores de los canales de calcio: nifedipino (Oelz 1989; Oelz 1992)
-
Inhibidores no selectivos de la fosfodiesterasa (teofilina o aminofilina) (Fisher 2000)
-
Magnesio (Dumont 2004)
De qué manera podría funcionar la intervención
Las intervenciones farmacológicas y no farmacológicas se utilizan para tratar la enfermedad de las alturas aguda; sin embargo, el descenso o la evacuación inmediata a una altura inferior puede salvar la vida y es el tratamiento de elección para los pacientes con enfermedad de las alturas grave completamente desarrollada (Luks 2014). Los tratamientos diferentes del descenso se consideran cuando el descenso no es posible debido al mal tiempo, al terreno o a otros factores logísticos.
Algunas de las maneras en las que los tratamientos farmacológicos y no farmacológicos podrían funcionar son las siguientes.
A) Mal de montaña agudo (MMA) y edema cerebral de las alturas (HACE)
-
Los inhibidores de la anhidrasa carbónica (acetazolamida, metazolamida) inhiben la anhidrasa carbónica en los riñones, lo que da lugar a bicarbonaturia y acidosis metabólica. Lo anterior provoca hiperventilación para lograr la compensación mediante una alcalosis respiratoria, y así este fármaco mejora la ventilación para responder de manera más completa a los estímulos hipóxicos en las alturas (Leaf 2007). La acetazolamida también puede causar vasodilatación pulmonar no relacionada con la inhibición de la anhidrasa carbónica (Höhne 2007).
-
Corticosteroides (dexametasona y medroxiprogesterona): la dexametasona bloquea la disfunción endotelial inducida por la hipoxia (Murata 2004; Murata 2005); y la medroxiprogesterona actúa como un estimulante respiratorio (Wright 2004).
-
Furosemida: este fármaco diurético reduciría la acumulación de líquido extravascular pulmonar; sin embargo, los diuréticos no tienen función alguna en el tratamiento del edema pulmonar de las alturas (HAPE), en particular porque muchos pacientes con HAPE tienen hipovolemia intravascular concurrente (Luks 2010).
-
Fármacos antiinflamatorios no esteroideos (AINE) (ibuprofeno, paracetamol, aspirina): un aumento en la permeabilidad microvascular cerebral mediado por las prostaglandinas puede contribuir a la fisiopatología del MMA, y el tratamiento con inhibidores de la sintetasa de prostaglandinas puede reducir esta respuesta (CATMAT 2007).
-
Los agonistas selectivos de los receptores de 5‐hidroxitriptamina (1) (sumatriptán) son vasoconstrictores cerebrales selectivos (Jafarian 2007b).
-
Fármacos anticonvulsivos (gabapentina): la gabapentina es un fármaco anticonvulsivo con propiedades analgésicas (Cheng 2006; Maneuf 2006).
-
El tratamiento hiperbárico (cámaras, bomba de aire manual, bolsas de presión de tela o bolsas de Gamow) simulan el descenso y proporcionan mejoría sintomática en pocas horas, como una medida temporal mientras se espera por el descenso (CATMAT 2007).
B) Edema pulmonar de las alturas (HAPE)
-
Los bloqueantes de los canales de calcio (p.ej. nifedipino) reducen la resistencia vascular pulmonar (Hackett 1992).
-
El óxido nítrico es un factor de relajación derivado del endotelio que atenúa la vasoconstricción pulmonar producida por la hipoxia (Blitzer 1996; Scherrer 1996; Schoene 2004; Wang 2003).
-
Inhibidores no selectivos de la fosfodiesterasa (teofilina o aminofilina): los efectos antihipoxia y antioxidación de la aminofilina pueden reducir la respiración periódica, la permeabilidad microvascular cerebral y pulmonar (Yang 2007), y la presión en la arteria pulmonar (Wright 2008).
-
Presión positiva de las vías respiratorias y otros tratamientos: respirar contra una presión espiratoria positiva mejora la saturación de oxígeno arterial (Bärtsch 1992; Larson 1992; Schoene 1985).
(Consultar Apéndice 3 para conocer los efectos adversos de las intervenciones farmacológicas).
Por qué es importante realizar esta revisión
Es importante realizar esta revisión sistemática por varias razones. Primero, muchas personas viajan a áreas recreativas localizadas a grandes alturas y, con el aumento progresivo de los niveles de viajes en todo el mundo, esta tendencia ha aumentado (CATMAT 2007). Segundo, hay una considerable incertidumbre acerca de la verdadera efectividad de los diferentes enfoques para el tratamiento de la HAI aguda (Adams 2004; Bärtsch 2004; CATMAT 2007; Elphick 2004), y se debe evaluar la seguridad y efectividad clínica. Lo anterior es especialmente importante si se considera que los viajeros pueden tener una falsa confianza en que estarán seguros a grandes alturas, pues creen que tienen un remedio efectivo en sus mochilas en caso de que enfermen.
Una revisión sistemática de la evidencia más actualizada, que incluya una evaluación rigurosa del riesgo de sesgo, ayudará a los médicos a tomar decisiones fundamentadas sobre la administración de intervenciones no farmacológicas y farmacológicas para tratar la HAI aguda.
Objetivos
Evaluar la efectividad clínica y la seguridad de las intervenciones (no farmacológicas y farmacológicas), como monoterapia o en cualquier combinación, para el tratamiento de la enfermedad de las alturas aguda.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron los ensayos controlados aleatorios (ECA), independientemente del estado de publicación (los ensayos pueden estar publicados o no publicados como artículo, resumen o carta). No se aplicó ninguna limitación de idioma ni de país. No se aplicaron restricciones con respecto a los períodos de seguimiento. Se excluyeron los estudios sobre el mal de montaña crónico o el síndrome de Monge (Leissner 2009; León‐Velarde 2010; Monge 1942). Se excluyeron los estudios cuasialeatorios, así como los estudios observacionales prospectivos para la evaluación de la efectividad clínica.
Tipos de participantes
Se incluyeron los ensayos en pacientes con enfermedad de las alturas (mal de montaña agudo/edema cerebral de las alturas, o edema pulmonar de las alturas, o ambos), con o sin antecedentes de enfermedad de las alturas. No se aplicaron restricciones por edad ni sexo.
Tipos de intervenciones
Intervenciones
A) Intervenciones no farmacológicas
-
Descenso
-
Cámara hiperbárica
-
Bolsa a presión portátil o bolsa de Gamow
-
Sistema respiratorio diseñado para conservar el aporte de oxígeno en la altura
-
Presión positiva de las vías respiratorias
B) Intervenciones farmacológicas
-
Oxígeno
-
Inhibidores de la anhidrasa carbónica (p.ej. acetazolamida)
-
Glucocorticosteroides: dexametasona y medroxiprogesterona
-
Fármacos antiinflamatorios no esteroideos (AINE) y paracetamol: ibuprofeno, aspirina y paracetamol
-
Agonista selectivo de receptores de 5‐hidroxitriptamina (1): sumatriptán
-
Óxido nítrico inhalado
-
Fármacos anticonvulsivos (p.ej. gabapentina)
-
Diuréticos (p.ej. furosemida)
-
Bloqueadores de los canales de calcio: nifedipino
-
Magnesio
Comparaciones
Placebo, monoterapia o cualquier combinación (intervenciones no farmacológicas más farmacológicas; intervenciones farmacológicas).
Tipos de medida de resultado
Resultados primarios
-
Mortalidad por todas las causas: se evaluó este resultado mediante tres enfoques.
-
El número de muertes por cualquier causa dividido por el número de participantes en cada grupo.
-
Para determinar cuántas muertes fueron causadas por HAPE o HACE: número de muertes por edema pulmonar de las alturas (HAPE) o edema cerebral de las alturas (HACE) dividido por el número de participantes en cada grupo.
-
Para determinar cuán mortales fueron el HAPE o el HACE: número de muertes por HAPE o HACE dividido por el número de participantes afectados por HAPE o HACE en cada grupo.
-
-
Alivio completo de los síntomas de mal de montaña agudo: definido como la ausencia completa de síntomas de mal de montaña agudo al final del estudio.
Resultados secundarios
-
Reducción de las puntuaciones de gravedad de la enfermedad del síndrome de montaña agudo (cefalea, náuseas, insomnio y mareo; solo o en cualquier combinación) evaluada mediante el Lake Louise Questionnaire (Roach 1993), el Environmental Symptoms Questionnaire (Sampson 1983) u otra escala validada. Debido a que estas escalas no son directamente equivalentes, se analizaron los resultados para cada escala por separado.
-
Eventos adversos.
-
Eventos adversos: eventos adversos totales y eventos adversos totales graves. Se definieron los eventos adversos como "cualquier episodio médico adverso que pueda presentarse durante el tratamiento con un producto farmacéutico, pero que no necesariamente tenga una relación causal con dicho tratamiento (Nebeker 2004). Se definió la reacción adversa al fármaco como "una respuesta a un fármaco que es nociva y no acostumbrada, y que se presenta con las dosis normalmente usadas en el hombre para la profilaxis, el diagnóstico o el tratamiento de las enfermedades, o para la modificación de las funciones fisiológicas" (Nebeker 2004).
-
(Ver Apéndice 3 para los eventos adversos que se describen habitualmente con los enfoques farmacológicos).
Métodos de búsqueda para la identificación de los estudios
Búsquedas electrónicas
We identified RCTs through literature searching with systematic and sensitive search strategies specifically designed to identify relevant trials without restrictions to language or publication status.
We searched the following databases for relevant trials.
-
Cochrane Central Register of Controlled Trials (CENTRAL; 2017, Issue 7)
-
MEDLINE (Ovid SP, 1966 to 10 August 2017)
-
Embase (www.embase.com, 1988 to 10 August 2017)
-
LILACS (BIREME interface, 1982 to 10 August 2017)
-
ISI Web of Science (1973 to 10 August 2017)
-
CINAHL (EBSCO host, 1982 to 10 August 2017)
-
Wanfang (Wanfangdata.com to 10 August 2017)
We developed a subject‐specific search strategy in MEDLINE, and used that as the basis for the search strategies in the other databases listed. Where appropriate, the search strategy was expanded with search terms for identifying RCTs. Our search strategies can be found in Appendix 4.
Búsqueda de otros recursos
We scanned the World Health Organization International Clinical Trials Registry Platform (who.int/trialsearch) for ongoing and unpublished trials on 19 August 2017; (see Appendix 5).
We developed the search strategy in consultation with the Information Specialist.
We scanned the reference lists and citations of included trials and any relevant systematic reviews identified for further references to additional trials.
Where necessary we contacted trial authors for additional information (February and March 2018 ).
Obtención y análisis de los datos
Selección de los estudios
Two review authors (DSR and IAR) independently assessed each reference identified by the search against the inclusion criteria. We resolved any disagreements by discussion. We consulted a third author (DO) as an arbiter if we could not reach agreement. We retrieved text in full for those references which appeared to meet the inclusion criteria, for further independent assessment by the same three review authors.
Extracción y manejo de los datos
We used a predefined form to extract data (Appendix 6). We extracted the following data: eligibility criteria; demographics (age, gender, and country); rate of ascent (metres/hour); final altitude reached (metres); Acute Mountain Syndrome scale; study design; history of high altitude illness (HAI); type of HAI; intervention; and outcomes. For eligible studies, four review authors in two groups (DSR‒IAR and DO‒YX) extracted the data using the form. We resolved discrepancies through discussion or, when required, we consulted a fifth author (RH). We entered data into Review Manager 5 (RevMan 5) software (Review Manager 2014), and checked for accuracy. When information regarding any of the above was unclear, we attempted to contact authors of the original reports to obtain further details.
Evaluación del riesgo de sesgo de los estudios incluidos
We used Cochrane’s tool for assessing risk of bias, a two‐part tool that addresses six specific domains: random sequence generation; allocation concealment; blinding of participants, personnel, and outcome assessors; incomplete outcome data; selective reporting; and other bias (Higgins 2011). The first part describes the risk of bias, the second part provides criteria for making judgements about the risk of bias from each of the six domains in the tool. Based on this tool, we implemented a 'Risk of bias' worksheet to be completed for included studies. We used bias definitions from Porta 2008 for coding the "Other sources of bias" domain. The risk of bias was assessed by four review authors in two groups (DSR‒IAR and DO‒YX). We resolved any disagreement through consultation with an additional author (RH or JVAF). We displayed the results by creating a 'Risk of bias' graph, and a 'Risk of bias' summary figure using Review Manager 5 software (Review Manager 2014). We present the risk of bias in the Results section. We also provide summary assessments of the risk of bias for each outcome within and across studies (see Characteristics of included studies and Risk of bias in included studies).
Medidas del efecto del tratamiento
We reviewed the evidence separately for the different interventions. For the binary outcomes (all‐cause mortality, complete relief of AMS symptoms, and adverse events), we presented results as summary risk ratios with 95% confidence intervals (95% CI). For continuous outcomes (reduction in illness severity scores) we reported the results as standardized mean difference with 95% CI instead of a mean difference as planned in the published protocol. This is a change from the protocol (Martí‐Carvajal 2012), and is explained in the Differences between protocol and review section.
Cuestiones relativas a la unidad de análisis
The unit of analysis was the patient. We collected and analysed a single measurement for each outcome from each participant.
Manejo de los datos faltantes
In the case of missing data on participants or missing statistics (such as standard deviations (SD)) we planned to contact the trial authors. If unsuccessful, we planned to base our main analysis on the number reaching follow‐up, but we planned to perform a sensitivity analysis for worst and best case scenarios. For all outcomes we carried out analyses, as far as possible, on an intention‐to‐treat basis; that is we planned to include all participants randomized to each group in the analyses. The denominator for each outcome in each trial was the number randomized minus any participants whose outcomes were known to be missing.
Evaluación de la heterogeneidad
We planned to evaluate the extent of heterogeneity by visual inspection of the forest plot, and to use the I² statistic to quantify it (Higgins 2003; Higgins 2011), investigating possible causes of heterogeneity through subgroup analysis. If pre‐specified subgroup analyses did not explain the statistical heterogeneity, we planned to perform a sensitivity analysis in which small studies would be excluded. However, due to the scarcity of information we were not able to perform the subgroup analysis. This is a change from the protocol (Martí‐Carvajal 2012), and is explained in the Differences between protocol and review section.
Evaluación de los sesgos de notificación
Where we suspected reporting bias, we planned to contact study authors asking them to provide missing outcome data. When this was not possible, and the missing data were thought to introduce serious bias, we planned to explore the impact of including such studies in the overall assessment of results by a sensitivity analysis. We also planned to assess whether the review was subject to publication bias by using a funnel plot to graphically illustrate variability between trials. If asymmetry was detected, we planned to explore causes other than publication bias. We planned to conduct a funnel plot if 10 or more RCTs were included in the review. However, due to the scarcity of information we were not able to perform these analyses. This is a change from the protocol (Martí‐Carvajal 2012), and is explained in the Differences between protocol and review section.
Síntesis de los datos
We planned to summarize the findings using both fixed‐effect and random‐effects models. In the presence of statistical heterogeneity, and an absence of small‐study effects, we expected the 95% CI from the random‐effects model to include the 95% CI from the fixed‐effect model. In this case, we planned to report only the data using the random‐effects model as it appropriately conveys heterogeneity. If a substantial difference was observed between both models, we planned to investigate this further as it can be due to an association between effect size and sample size. However, due to the scarcity of information we were not able to perform this analysis. This is a change from the protocol (Martí‐Carvajal 2012), and is explained in the Differences between protocol and review section.
Análisis de subgrupos e investigación de la heterogeneidad
We anticipated clinical heterogeneity in the effect of the intervention and we intended to conduct the following subgroup analyses, if the data were available.
-
Final altitude (metres)
-
High altitude illness history
-
The state of pre‐acclimatization
-
The regular intake of medication
-
Pre‐existing disease
We planned to perform subgroup analysis only for primary outcomes. However, due to the scarcity of information, we were not able to perform this analysis. This is a change from the protocol (Martí‐Carvajal 2012), and is explained in the Differences between protocol and review section.
Análisis de sensibilidad
We planned to conduct a sensitivity analysis comparing the results using all trials as follows.
-
For those RCTs with high methodological quality (studies classified as having a 'low risk of bias' (Higgins 2011)), we planned to choose three core domains instead of all: generation of allocation sequence, incomplete outcome data, and selective reporting bias.
-
For dichotomous outcomes, we planned to conduct ‘best‐case’ and ‘worst‐case’ scenarios. The ‘best‐case’ scenario is that all participants with missing outcomes in the experimental intervention group had good outcomes and all those with missing outcomes in the control intervention group had poor outcomes; the ‘worst‐case’ scenario is the converse (Higgins 2011).
We also planned to evaluate the risk of attrition bias, as estimated by the percentage of participants lost to follow‐up. Those studies with a total attrition of more than 20% or where differences between the groups exceed 10%, or both, would be included in the review but excluded from the meta‐analysis trials. However, due to the scarcity of information we were not able to perform this analysis. This is a change from the protocol (Martí‐Carvajal 2012), and is explained in the Differences between protocol and review section.
'Summary of findings' tables and GRADE
We used the principles of the GRADE system to assess the quality of the body of evidence associated with specific outcomes (Guyatt 2008): all‐cause mortality, by high altitude pulmonary oedema (HAPE), or by high altitude cerebral oedema (HACE); complete relief of acute mountain syndrome (AMS) symptoms; reduction in illness severity scores; and adverse events (safety). We developed 'Summary of findings’ (SoF) tables using GRADE software (GRADEpro GDT) for the comparisons.
-
Non‐pharmacological interventions for treating acute high altitude illness (Summary of findings table 1).
-
Pharmacological interventions for treating acute high altitude illness (Summary of findings table 2).
The GRADE approach appraises the quality of a body of evidence based on the extent to which one can be confident that an estimate of effect or association reflects the item being assessed. The quality of a body of evidence considers within‐study risk of bias (methodological quality), the directness of the evidence, heterogeneity of the data, precision of effect estimates and risk of publication bias. We downgraded the evidence one level or two taking into account these criteria. When imprecision was one of the reasons to downgrade the evidence, we provide the corresponding optimal information size calculations in Appendix 7.
We generated a 'Summary of findings' table for each of the interventions stated in the protocol where we found studies reporting the primary outcome: all‐cause mortality and complete relief of AMS symptoms. The 'Summary of findings' tables provide outcome‐specific information concerning the overall quality of evidence, the magnitude of effect of the interventions examined, and the amount of available data on the outcomes we considered.
Results
Description of studies
Results of the search
Figure 1 shows the review flow chart.

Study flow diagram.
We ran the search in August 2017 and it yielded 3706 records. We identified 3490 records through database searching, and retrieved 216 references from other sources. We excluded 555 duplicated references, leaving 3151 unique references. We screened the unique references by reading titles and abstracts. From these 3151 references, we identified 39 potentially eligible citations that we reviewed in full text, from which we excluded 24. Of the remaining 15 references, we identified 13 studies of high altitude illness (HAI) which met the inclusion criteria (published in 13 articles), and two ongoing studies (ChiCTR‐TRC‐13003298; NCT01522326).
Included studies
We included 13 studies (468 participants) in the review (Bärtsch 1990; Bärtsch 1993; Dumont 2004; Ferrazzini 1987; Grissom 1992; Harris 2003; Jafarian 2007a; Kasic 1991; Keller 1995; Li 2006; Utiger 2002; Wang 1998; Wright 1994). See also Characteristics of included studies tables.
Study design
All studies were parallel RCTs. The number of participants varied between 12 (Grissom 1992), and 74 (Harris 2003).
Participants
The proportion of men in the studies ranged from 40% (Harris 2003), to 95% (Bärtsch 1990), except for two studies that included only men (Li 2006; Wang 1998). Distribution by sex was not reported in two studies (Dumont 2004; Wright 1994). In most of the studies the participants were adults aged 18 years old or more. However, two studies also included teenagers (Harris 2003; Li 2006). The age of participants ranged from 13 to 61 years old. Three studies did not report the age distribution (Dumont 2004; Ferrazzini 1987; Wright 1994).
Studies included participants with mild to more severe symptoms of acute high altitude illness, and used different scores to define HAI as inclusion criteria (see Appendix 8). For instance, Wang 1998 recruited participants with HAPE using the definition of high altitude illnesses set forth by the Ad Hoc Committee on High Altitude Illnesses of Chinese Medical Association (Chinese Medical Association 1996). This score is different to the Lake Louise score.
Setting
Six studies took place in the Swiss‒Italian border region (Bärtsch 1990; Bärtsch 1993; Dumont 2004; Ferrazzini 1987; Keller 1995; Utiger 2002). The remaining studies were carried out in Alaska (Grissom 1992), the USA (Kasic 1991), Nepal (Harris 2003), Iran (Jafarian 2007a), Tibet (Li 2006), and China (Wang 1998). One study took place in the border areas between China, India and Pakistan (Wright 1994).
Two studies were carried out at high altitude (1500 to 3500 metres; Kasic 1991; Wright 1994), and the remaining in very high altitude (3500 to 5500 metres). No studies were done at extreme altitude (above 5500 metres).
Interventions
A variety of interventions were assessed in the studies. Non‐pharmacological intervention studies were limited to the hyperbaric chamber (Bärtsch 1993; Kasic 1991; Keller 1995), while pharmacological interventions were: oxygen (Bärtsch 1990), acetazolamide (Grissom 1992; Wright 1994), dexamethasone (Ferrazzini 1987; Keller 1995; Li 2006; Wang 1998), ibuprofen (Harris 2003), paracetamol (Harris 2003), sumatriptan (Utiger 2002), inhaled nitric oxide (Li 2006; Wang 1998), gabapentin (Jafarian 2007a), nifedipine (Wang 1998), and magnesium (Dumont 2004). Other drugs were included as part of the control group, such as aminophylline (Li 2006; Wang 1998), and furosemide (Li 2006; Wang 1998). We found no studies assessing descent, portable pressure bags or breathing systems.
Six studies were placebo controlled (Dumont 2004; Ferrazzini 1987; Grissom 1992; Jafarian 2007a; Utiger 2002; Wright 1994). The remaining seven studies used a treatment control group. The control group was described as standard care in two studies. The standard care was a combination of aminophylline and dexamethasone plus furosemide (Li 2006), or plus furosemide and oxygen (Wang 1998).
Funding sources
The majority of studies were funded by medical societies, universities or grants from governments or hospitals. In four studies, the private companies that developed the evaluated technologies provided financial support for the study (Harris 2003; Jafarian 2007a; Utiger 2002; Wright 1994). Only in Harris 2003 was there a statement about the independent control of the study by the researchers.
Outcomes
From the four outcomes predefined in the protocol, none of the included studies reported all‐cause mortality. Only two studies reported the proportion of participants who experienced a complete relief of symptoms (Ferrazzini 1987; Grissom 1992). All of the studies bar Wang 1998 evaluated reduction in illness severity scores. Utiger 2002 also used a headache score (0 = none, 1 = mild, 2 = moderate, 3 = severe headache), while Harris 2003 and Jafarian 2007a used a standard visual analogue scale (VAS). Four studies reported whether or not participants experienced adverse events (Dumont 2004; Grissom 1992; Jafarian 2007a; Kasic 1991).
In most of the RCTs the follow‐up was of 24 hours or less. The exceptions were Li 2006 and Wright 1994, who reported a follow‐up of three and five days, respectively; and Wang 1998, where follow‐up was until recovery.
Excluded studies
We excluded 24 studies for the following reasons: non‐randomized trials, narrative review, preventive studies or did not meet other eligibility criteria (Anand 1998; Bärtsch 1992; Bärtsch 1994; Bates 2007; Benedetti 2015; Bradwell 1988; Broome 1994; Brown 1977; Burtscher 1995; Deshwal 2012; Fagenholz 2007; Forster 1982; Forwand 1968; Levine 1989; Li 2010; Maggiorini 1995; Meehan 1986; Oelz 1989; Oelz 1992; Roggla 2001; Wright 1988; Yan 2010; Yanamandra 2016; Zhang 2012).
See the table Characteristics of excluded studies for further details.
Studies awaiting classification
There are no studies awaiting classification.
Ongoing studies
We identified two ongoing studies. ChiCTR‐TRC‐13003298 aims to assess the effect of oral trimetazidine for reducing the symptoms of acute mountain sickness and improving exercise performance. However, the information provided in the World Health Organization International Clinical Trials Registry Platform (who.int/trialsearch), is not clear enough to allow us to define eligibility and we have not found any related publications. The second study is taking place in Nepal, and compares ibuprofen with metoclopramide (NCT01522326) (see Characteristics of ongoing studies).
Risk of bias in included studies
The risk of bias in terms of allocation, blinding, outcome, reporting, and other criteria is summarized in Figure 2 and Figure 3.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
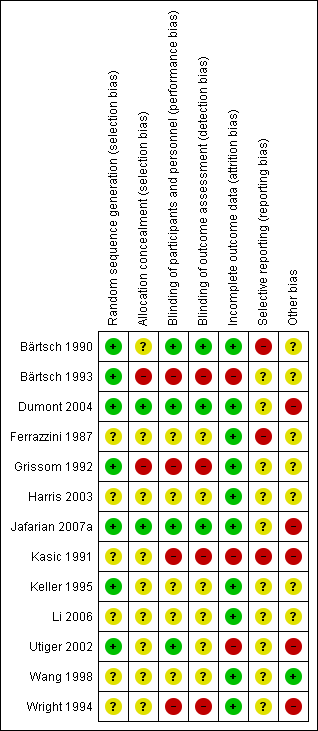
Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
Random sequence generation
Seven studies had low risk of selection bias. Two studies used random sequence generation to minimize selection bias, either by using a random number table (Dumont 2004), or computer‐generated randomization codes (Jafarian 2007a). In five studies randomization was performed in blocks (Bärtsch 1990; Bärtsch 1993; Grissom 1992; Keller 1995; Utiger 2002).
Six studies did not provide enough information to assess the sequence generation (Ferrazzini 1987; Harris 2003; Kasic 1991; Li 2006; Wang 1998; Wright 1994).
Allocation concealment
Two studies explicitly reported how the allocation was concealed: in Jafarian 2007a the computer‐generated randomization codes were exclusively kept by the pharmacist; and in Dumont 2004 the random numbers table was used centrally by the Hospital's Pharmacy. Two studies seem to have compromised allocation concealment: in Grissom 1992, a participant allergic to sulfa‐drug was manually assigned to the placebo group; and in Bärtsch 1993, the researcher manually adjusted the order of to‐be‐assigned blocks. The remaining studies did not provide enough information regarding allocation concealment to assess the risk of bias.
Blinding
Performance bias
Four studies had appropriate blinding methods for participants and personnel (Bärtsch 1990; Dumont 2004; Jafarian 2007aUtiger 2002). Four studies had high risk of bias for this domain considering the subjectivity of the outcomes assessed: two were not blinded (Bärtsch 1993; Kasic 1991); and authors from two studies stated that blinding was compromised during the study (Grissom 1992; Wright 1994). The remaining studies did not provide adequate data to allow assessment of blinding.
Detection bias
Three studies had appropriate methods of blinding assessment outcome (Bärtsch 1990; Dumont 2004; Jafarian 2007a). Four studies had high risk of bias for this domain: two were not blinded in spite of evidently different interventions (Bärtsch 1993; Kasic 1991); and in two studies blinding was compromised (Grissom 1992; Wright 1994). The remaining studies did not provide adequate data to allow assessment of blinding.
Incomplete outcome data
Most of the studies had low risk of attrition bias. The studies provided detailed characteristics of the recruited participants and followed up throughout their trials. Three studies had high risk of bias for this domain: one study, though the authors did not report any withdrawal, reported a small number of participants at the end of the study (Utiger 2002). In Bärtsch 1993, a subgroup of participants were excluded after randomization. And in the third study there was incomplete outcome data due to errors that occurred in the monitoring equipment (Kasic 1991).
Selective reporting
We had not enough information to determine if there was a high risk of bias from selective reporting, since the protocol was not available for any of them. Moreover, we considered three studies to be at high risk of selective reporting because outcome data was presented only graphically (Bärtsch 1990; Ferrazzini 1987; Kasic 1991).
Other potential sources of bias
One study had low risk of other potential bias (Wang 1998). However, seven studies inadequately reported the research design, such as sample size calculation, or had not reported sources of funding; therefore we considered them as having an unclear risk of bias (Bärtsch 1990; Bärtsch 1993; Ferrazzini 1987; Grissom 1992; Harris 2003; Keller 1995; Li 2006).
Five studies were judged to have high risk of bias (Dumont 2004; Jafarian 2007a; Kasic 1991; Utiger 2002; Wright 1994). In Utiger 2002, there were baseline differences after randomization (all females were in the placebo group). In two studies, the potential carry‐over effect was a source of bias since participants in the reported study had sequentially participated in a previous trial (Dumont 2004; Wright 1994).
Effects of interventions
See: Summary of findings for the main comparison Non‐pharmacological interventions for treating acute high altitude illness; Summary of findings 2 Pharmacological interventions for treating acute high altitude illness
See summary of findings Table for the main comparison; summary of findings Table 2.
We have obtained some of the numerical results below from graphs in the included papers rather than numerical results given in the text. We have indicated in the results below when this has been done.
Group 1: non‐pharmacological interventions
Primary outcomes
All‐cause mortality (comparison 1, outcome 1.1)
We found no trials reporting this outcome when using the following non‐pharmacological interventions: descent from altitude; use of a portable pressure bag (Gamow Bag); breathing systems for oxygen delivery; or the use of positive airway pressure. In addition, we identified three studies which compared the use of a hyperbaric chamber to simulate descent (Bärtsch 1993; Kasic 1991; Keller 1995), enrolling a total of 124 participants (26% of the total in this review), and none specifically stated that mortality was an outcome of interest. No deaths were reported.
Complete relief of acute mountain sickness symptoms (comparison 1, outcome 2.1)
We found no trials reporting this outcome when using the following non‐pharmacological interventions: descent from altitude; use of a portable pressure bag (Gamow Bag); use of a hyperbaric chamber; breathing systems for oxygen delivery; or the use of positive airway pressure.
Secondary outcomes
Reduction in illness severity scores of acute mountain syndrome (comparison 1, outcome 3.1)
We found no trials reporting this outcome when using the following non‐pharmacological interventions: descent from altitude; use of a portable pressure bag (Gamow Bag); breathing systems for oxygen delivery; or the use of positive airway pressure.
3.1 Hyperbaric chamber simulated descent
Three studies reported this outcome, enrolling a total of 124 participants (26% of the total in this review). No pooling of data was possible however, due to clinical heterogeneity arising from the use of different comparators in each trial.
Kasic 1991 included 29 participants, and compared a pressurization of 120 mmHg (equivalent to 160 millibars) versus supplementary oxygen. Clinical outcome data was only presented graphically. For the pressurization group, the estimated score mean is near to 0.7; and for the oxygen group it is near to 0.8 (data estimated from Kasic 1991, Figure 2). The authors stated that both groups had a reduction in symptom scores compared to baseline but there were no important differences between groups.
Bärtsch 1993 included 64 participants, and compared simulated descent using a pressure of 193 millibars versus a pressure of 20 millibars, with a third group in which participants had bed rest. This trial reported both a clinical score, and the Acute Mountain Syndrome ‐ Cerebral (AMS‐C) score, a subscore of the Environmental Symptoms Questionnaire developed by Sampson 1983. The AMS‐C score was measured after one hour and 12 hours of treatment, as well as at rest. There were no clear differences in the clinical severity scores between the three trial groups 12 hours after treatment (pressure increases of 193 millibar group (mean = 2.5), 20 millibar group (mean = 3.1), and rest only (mean = 2.3); estimated reduction of 0.6 points); or in terms of the AMS‐C score (pressure increases of 193 millibar group (mean = 1.02), 20 millibar group (mean = 1.36), and rest only (mean = 0.92)). We downgraded the quality of evidence from high to low due to risk‐of‐bias issues as well as imprecision (summary of findings Table for the main comparison).
Keller 1995 included 31 participants, and compared simulated descent using a pressure of 193 millibars with dexamethasone. This trial reported a reduction in clinical score at one hour when a hyperbaric chamber was compared with dexamethasone (mean of −4.0 points and −1.5 points, respectively). Similar results were found when Lake Louise Score, and AMS‐C score were analysed. However, after 11 hours the clinical scores in the simulated descent group were higher than in those who had received dexamethasone (mean of −1.0 and −4.1, respectively; higher results mean worse symptoms).
Adverse events (comparison 1, outcome 4.1)
We found no trials reporting this outcome when using the following non‐pharmacological interventions: descent from altitude; use of a portable pressure bag (Gamow Bag); breathing systems for oxygen delivery; or the use of positive airway pressure.
4.1. Hyperbaric chamber simulated descent
Kasic 1991 included 29 participants, and stated there were no complications associated with the use of the hyperbaric chamber (no events in either arm). We downgraded the quality of evidence from high to low due to risk of bias and imprecision issues (summary of findings Table for the main comparison).
Group 2: pharmacological interventions
Primary outcomes
All‐cause mortality (comparison 2, outcome 2.1)
We found no trials specifically reporting this outcome when using the following pharmacological interventions: oxygen; carbonic anhydrase inhibitors; glucocorticosteroids; non‐steroidal anti‐inflammatory drugs and acetaminophen; selective 5‐HT(1) antagonists; inhaled nitric oxide; anticonvulsant drugs; diuretics; calcium channel blockers; phosphodiesterase inhibitors; or magnesium.
Complete relief of acute mountain sickness symptoms (comparison 2, outcome 2.2 and 2.3)
We found no trials specifically reporting this outcome when using the following pharmacological interventions: oxygen; carbonic anhydrase inhibitors; selective 5‐HT(1) antagonists; inhaled nitric oxide; anticonvulsant drugs; diuretics; calcium channel blockers; phosphodiesterase inhibitors; or magnesium.
2.2. Non‐steroidal anti‐inflammatories and paracetamol
Grissom 1992 enrolled 12 participants (3% of the total in this Cochrane Review), and compared the NSAID ibuprofen 400 mg with paracetamol 1000 mg (six participants to each). At 24 hours five out of six (83%) participants in the ibuprofen group were healthy, compared to none (0%) of the six participants in the paracetamol group (estimated RR 11, CI 95% 0.74 to 163.4).
2.3. Glucocorticosteroids
Ferrazzini 1987 enrolled 35 participants (3% of the total in this Cochrane Review), 17 (49%) allocated to dexamethasone and 18 (51%) to a placebo. Eight out of 17 (47%) participants treated with dexamethasone had all symptoms and signs of acute mountain sickness resolved (score 0) after 12 and 16 hours, compared to none of the 18 (0%) participants who had received placebo (RR not estimable). We downgraded the quality of evidence from high to low due to risk of bias and imprecision issues (summary of findings Table 2).
Secondary outcomes
Reduction in illness severity scores of acute mountain syndrome (comparison 2, outcomes 2.4 to 2.11)
We found no trials specifically reporting this outcome when using the following pharmacological interventions: carbonic anhydrase inhibitors; diuretics; calcium channel blockers; or phosphodiesterase inhibitors.
2.4. Oxygen
Bärtsch 1990 enrolled 13 participants (3% of the total in this Cochrane Review) in the comparison of 33% oxygen (six participants, 46%) and a control group breathing normal compressed air (seven participants, 54%). This trial reported that the oxygen group had a greater decrease in the AMS‐C score compared with the normal air group (estimated mean score after treatment = 1.1 versus 1.0; data estimated from Bärtsch 1990, figure 1).
2.5. Carbonic anhydrase inhibitors
Two studies reported this outcome, enrolling a total of 25 participants, 5% of the total number of participants included in this Cochrane Review (Grissom 1992; Wright 1994). There was no clear benefit from the use of acetazolamide compared to placebo (SMD 1.15 lower with acetazolamide, 95% CI 2.56 lower to 0.27 higher; I² = 58%; Analysis 1.1). We downgraded the quality of evidence from high to low due to risk of bias, and inconsistency issues (summary of findings Table 2).
2.6. Glucocorticosteroids
Ferrazzini 1987 enrolled 35 participants (7.5% of the total in this Cochrane Review), 17 (49%) allocated to dexamethasone and 18 (51%) to a placebo. The mean AMS score dropped from 5.4 (SD 1.7) to 1.3 in the dexamethasone group, and from 4.8 (SD 1) to 4.2 (SD 2.2). Authors reported that the change in the acute mountain sickness score was 4.1 in the dexamethasone group, and 0.4 in the placebo group, a difference of 3.7 units between these groups (SD for each group not reported; confidence interval of the mean difference reported by authors = −5.3 to −2.2). We downgraded the quality of evidence from high to moderate due to the risk of bias (summary of findings Table 2).
2.7. Non‐steroidal anti‐inflammatory drugs (NSAIDs) and paracetamol
Harris 2003 enrolled 74 participants (16% of the total in this Cochrane Review), and compared the NSAID ibuprofen 400 mg (39 (53%) participants) with paracetamol 1000 mg (35 (47%) participants). At one hour, there were no differences in the mean score between the ibuprofen group (mean = 1.8; SD = 1.69), and the paracetamol group (mean = 2.1; SD = 2.18). Within two hours of treatment, the mean of headache intensity was lower in both groups, but there were no differences between the ibuprofen (mean = 0.8; SD = 1.38), and the paracetamol group (mean = 0.9; SD = 1.6).
2.8. Selective 5‐hydroxytryptamine (1) receptor agonist
Utiger 2002 enrolled 29 participants (6% of the total in this Cochrane Review), and compared sumatriptan in 14 participants (48%) with a placebo in 15 participants (52%). This trial reported that the headache score decreased significantly in both study groups at one, three and 12 hours after medication. However, there were no significant differences between sumatriptan and placebo at any particular moment of the trial: within three hours the mean score in sumatriptan group was 1.5 (SD = 0.9) versus 1.7 (SD = 1.1) in the placebo group. Within 12 hours (n = 20) sumatriptan mean was 1.5 (SD = 1.1) versus 1.7 for the placebo group (SD = 0.9).
2.9. Inhaled nitric oxide
Li 2006 enrolled 47 participants (10% of the total participants in this Cochrane Review) with 24 (51%) allocated to receive nitric oxide compared to 23 (49%) allocated to a control treatment. Authors reported that both groups had a reduction in symptom scores using the Lake Louise Score, with a mean of 1.78 for the nitric oxide group (SD 1.31) versus a mean of 2.43 for the standard care group (SD 1.56).
2.10. Anticonvulsant drugs
Jafarian 2007a enrolled 24 participants (5% of the total participants in this Cochrane Review), 12 to each of a gabapentin group and a placebo group. Within one hour of treatment there were no differences in the mean VAS score between the gabapentin group (mean = 2.92; SD = 2.91), and the placebo group (mean = 4.75; SD = 3.11. Mean difference not reported by trial authors). We downgraded the quality of evidence from high to low due to risk of bias, and imprecision issues (summary of findings Table 2).
2.11. Magnesium
Dumont 2004 enrolled 25 participants (5% of the total in this Cochrane Review) with 12 (48%) allocated to receive magnesium and 13 (52%) to receive a placebo preparation. Authors reported that the mean scores of both groups at two hours were comparable (magnesium sulphate mean score = 9; SD = 3.5; placebo mean score = 10.3; SD = 2.8. Mean difference not reported by trial authors). We downgraded the quality of evidence from high to low due to risk of bias, and imprecision issues (summary of findings Table 2).
Adverse events (outcome 2 and outcomes 2.12)
We found no trials specifically reporting this outcome when using the following pharmacological interventions: oxygen; glucocorticosteroids; non‐steroidal anti‐inflammatory drugs and acetaminophen; selective 5‐HT(1) antagonists; inhaled nitric oxide; diuretics; calcium channel blockers; or phosphodiesterase inhibitors.
2.12. Carbonic anhydrase inhibitors
Grissom 1992 stated that no significant adverse events of acetazolamide were found (0% for acetazolamide arm; data not reported for placebo arm; RR not estimable). We downgraded the quality of evidence from high to low due to risk of bias and imprecision issues (summary of findings Table 2).
2.13. Anticonvulsant drugs
Jafarian 2007a enrolled 24 participants (5% of the total participants in this Cochrane Review), 12 to each assessed group. The authors reported no adverse events (0% for both arms; RR not reported by trial authors). We downgraded the quality of evidence from high to low due to risk of bias, and imprecision issues (summary of findings Table 2).
2.14. Magnesium
Dumont 2004 enrolled 25 participants (5% of the total in this Cochrane Review) with 12 (48%) allocated to receive magnesium and 13 (52%) to receive a placebo preparation. Authors reported that 9 out of 12 participants who had received intravenous magnesium sulphate had flushing, compared to 1 out of 13 participants who had received placebo (75% versus 7%, respectively; RR not reported). We downgraded the quality of evidence from high to low due to risk of bias and imprecision issues (summary of findings Table 2).
Discusión
Resumen de los resultados principales
Mediante la estrategia de búsqueda se recuperaron 3706 artículos. Después de aplicar los criterios de elegibilidad, se incluyeron 13 estudios y 468 participantes en la revisión, y se clasificaron dos estudios en curso. Se encontró evidencia escasa de ensayos pequeños que evaluaron una amplia variedad de tratamientos para la enfermedad de las alturas (EA). Todos los estudios incluyeron adultos, y dos estudios incluyeron tanto adolescentes como adultos. Los 13 estudios se realizaron en áreas de gran altitud, principalmente en los Alpes europeos. Doce estudios incluyeron participantes con mal de montaña agudo, y un estudio incluyó participantes con edema pulmonar de las alturas agudo. El seguimiento fue generalmente menor de un día. Los resultados para las comparaciones principales se presentan de la manera siguiente.
Intervenciones no farmacológicas (tres estudios, 124 participantes)
Los ensayos incluidos no informaron la mortalidad por todas las causas ni el alivio completo de los síntomas de MMA. Con respecto a la reducción en la puntuación de la gravedad de los síntomas, se encontraron para el descenso simulado de 193 milibares versus 20 milibares, puntuaciones medias (lectura de los gráficos) de 2,5 y 3,1 después de 12 horas de tratamiento, respectivamente (un estudio; 64 participantes; evidencia de baja calidad). Además, no se encontraron complicaciones con el uso de la cámara hiperbárica versus el oxígeno complementario (un estudio; 29 participantes; evidencia de baja calidad).
Intervenciones farmacológicas (11 ensayos, 375 participantes)
Los ensayos incluidos no informaron la mortalidad por cualquier causa. Un ensayo encontró una mayor proporción de participantes con alivio completo de los síntomas de MMA después de 12 y 16 horas de la administración de dexametasona, en comparación con placebo (47,1% versus 0%, respectivamente; CR no estimable; un estudio; 35 participantes; evidencia de baja calidad). Asimismo, los datos sobre acetazolamida versus placebo no mostraron diferencias en cuanto a la reducción de la puntuación de la gravedad de los síntomas (diferencia de medias estandarizada [DME] −1,15; IC del 95%: −2,56 a 0,27; dos estudios, 25 participantes; evidencia de baja calidad). Un ensayo encontró efectos beneficiosos, en cuanto a la reducción en la puntuación de la gravedad de los síntomas, cuando se comparó dexametasona con placebo (diferencia en el cambio en la puntuación de MMA: 3,7 unidades, informado por los autores; un estudio; 35 pacientes; evidencia de calidad moderada). Dos ensayos adicionales sobre gabapentina versus placebo y magnesio versus placebo no encontraron reducciones en la gravedad de la puntuación de los síntomas al final del tratamiento. (Para gabapentina versus placebo: puntuación media de la EAV 2,92 versus 4,75; respectivamente; un estudio; 24 participantes; evidencia de baja calidad. Para magnesio versus placebo: media de las puntuaciones 9 y 10,3 unidades, respectivamente; un estudio; 25 participantes; evidencia de baja calidad). Con respecto a los efectos adversos después del tratamiento, los ensayos que compararon acetazolamida versus placebo y gabapentina versus placebo no encontraron eventos adversos. (Para el ensayo de acetazolamida: un estudio; 25 participantes; evidencia de baja calidad; para el ensayo de gabapentina: un estudio; 24 participantes; evidencia de baja calidad). Un ensayo que comparó sulfato de magnesio versus placebo encontró que el rubor fue un evento frecuente en el brazo de magnesio. (Porcentaje de rubor: 75% versus 7,7%, respectivamente; un estudio; 25 participantes; evidencia de baja calidad).
No se encontraron estudios que abordaran intervenciones como el descenso, la bolsa de presión portátil o la bolsa de Gamow, el sistema de respiración diseñado para conservar los suministros de oxígeno en la altura, la presión positiva de las vías respiratorias, la aspirina o la medroxiprogesterona.
Compleción y aplicabilidad general de las pruebas
La evidencia para apoyar o rechazar la utilidad de una amplia gama de enfoques para tratar la HAI está incompleta. Se identificó un número limitado de estudios dirigidos a la efectividad y la seguridad de las posibles intervenciones para el tratamiento de la enfermedad de las alturas aguda (13 estudios y 468 participantes). La mayoría de los estudios no incluyeron participantes que presentaran edema pulmonar de las alturas (HAPE), y ninguno de los estudios incluidos evaluó el tratamiento del edema cerebral de las alturas (HACE). El HAPE y el HACE son las formas más graves de la enfermedad de las alturas (EA). Por lo tanto, no hay evidencia suficiente sobre los efectos de las intervenciones para estas afecciones. Además, el único estudio que incluyó participantes que presentaron HAPE no informó el resultado más grave, la mortalidad. Asimismo, un escenario común fue la identificación de solo un estudio para las numerosas comparaciones evaluadas, lo que limitó la capacidad de abordar los objetivos de esta revisión.
Pocos estudios incluidos informaron los resultados primarios y secundarios de interés para la revisión. Además, se encontró una definición variable de "atención estándar" entre los estudios incluidos. En algunos casos, la "atención estándar" control incluyó la administración de oxígeno, furosemida y aminofilina. Lo anterior puede ser desafiante cuando se extrapola la evidencia a la práctica, ya que puede no reflejar la atención estándar proporcionada en otros contextos o países. También se encontró que el informe de los resultados no estuvo completo en muchos estudios. Algunos estudios informaron resultados compuestos para la "curación" que incluyeron resultados radiográficos y hallazgos clínicos. Estos resultados son difíciles de interpretar porque no es posible evaluar en qué medida esta definición se basó en los resultados radiográficos o clínicos.
Calidad de la evidencia
Se utilizó el sistema GRADE para evaluar la calidad del grupo de evidencia asociado con los resultados primarios y secundarios. Ver Resumen de los hallazgos, tabla 1 y Resumen de los hallazgos, tabla 2 para las evaluaciones completas y la justificación de las calificaciones. La calidad de la evidencia se disminuyó en la mayoría de los casos debido al riesgo, así como a la imprecisión (no se logró el tamaño de información óptimo [TIO] debido a los tamaños de la muestra insuficientes). Además, la mayoría de los estudios incluidos informaron de manera deficiente en la metodología y los datos de resultados. El informe deficiente se puede deber al hecho de que más de la mitad de los estudios (ocho de 13) se realizaron en los años ochenta y noventa, cuando aún no se habían propuesto los estándares para el informe. Lo anterior explica que un gran número de dominios en la evaluación del riesgo de sesgo tuvieran una valoración de "incierto". El cegamiento en la mayoría de los casos no fue claro o se informó como no posible; lo anterior puede limitar la interpretación de los resultados de los estudios, ya que la mayoría de los resultados se midieron con puntuaciones de síntomas informadas por los participantes. Además, el financiamiento fue una fuente de sesgo en un grupo de estudios, y no se garantizó la independencia de los equipos de investigación. Para detalles adicionales sobre el riesgo de sesgo, ver Riesgo de sesgo en los estudios incluidos. Finalmente, no fue posible abordar el riesgo de sesgo de publicación con un enfoque estadístico, ya que no se encontraron suficientes estudios para realizar el análisis. Sin embargo, no se encontró evidencia que apoyara la sospecha de sesgo de publicación (p.ej. ensayos clínicos completados en registros no publicados).
Sesgos potenciales en el proceso de revisión
Se siguió la metodología para las revisiones sistemáticas esbozada en el Manual Cochrane para Revisiones Sistemáticas de Intervenciones(Higgins 2011). Se realizó una búsqueda exhaustiva de la evidencia para la enfermedad de las alturas (EA). No obstante, a menudo los informes estuvieron incompletos y los intentos de solicitar aclaración fueron infructuosos. Además, un solo autor realizó una extracción de datos y una evaluación del riesgo de sesgo para los estudios informados en chino; no obstante, los resultados se discutieron con todo el equipo de revisión.
Cuando se consideraron los resultados de los estudios, la mayoría de los resultados fueron narrativos cuando se proporcionaron en el artículo en cuestión, ya que el metanálisis no fue posible debido a la heterogeneidad clínica. Finalmente, no se incluyeron estudios observacionales para la evaluación de la incidencia de los eventos adversos (Ver Diferencias entre protocolo y revisión). El informe de los eventos adversos en los ensayos controlados aleatorios incluidos fue limitado, por lo que es posible que esta revisión no evalúe de manera exhaustiva este resultado.
Acuerdos y desacuerdos con otros estudios o revisiones
Se encontraron otras revisiones sistemáticas que abordaron intervenciones farmacológicas para la enfermedad de las alturas (Murdoch 2010; Seupaul 2012; Tang 2014; Xu 2014); pero todas incluyeron ensayos controlados aleatorios que evaluaron medidas preventivas, pero no el tratamiento, para la HAI. Si se considera la vía fisiopatológica común subyacente, muchas intervenciones utilizadas para la prevención también se utilizan para el tratamiento (Ver Nieto Estrada 2017 para una evaluación de las intervenciones farmacológicas utilizadas de manera habitual para la prevención de la enfermedad de las alturas).

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
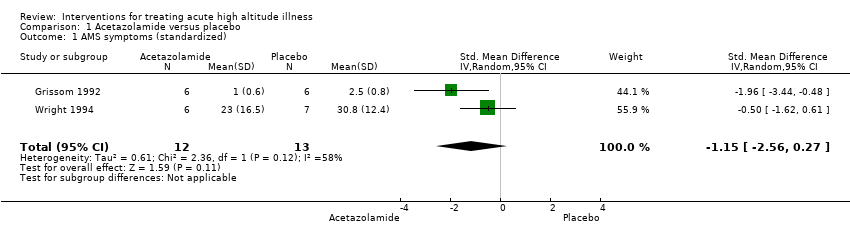
Comparison 1 Acetazolamide versus placebo, Outcome 1 AMS symptoms (standardized).
| Non‐pharmacological interventions for treating acute high altitude illness | ||||||
| Patient or population: people suffering from high altitude illness | ||||||
| Outcomes and intervention | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with various interventions | Risk with non‐pharmacological interventions | |||||
| All‐cause mortality | ‐ | ‐ | ‐ | ‐ | ‐ | Not reported |
| Complete relief of AMS symptoms | ‐ | ‐ | ‐ | ‐ | ‐ | Not reported |
| Reduction in symptom score severity at 12 hours (Clinical score: ranged from 0 to 11 (worse)) Intervention: Simulated descent of 193 millibars versus 20 millibars | The mean score in the control group was 3.1 | The mean score in the intervention group was 2.5 | 0.6 points lower with intervention | 64 (1 RCT) | ⊕⊕⊝⊝ | |
| Adverse effects during treatment Intervention: Hyperbaric chamber/ 160 millibars versus supplementary oxygen | 0 per 1000 | 0 per 1000 | Nil | 29 | ⊕⊕⊝⊝ | |
| *The risk in the intervention group (and its 95% CI) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Quality of evidence downgraded by two levels due to serious risk of bias (performance bias (blinding was not specified), attrition bias and selective reporting bias) and serious imprecision (optimal information size criteria not achieved) | ||||||
| Pharmacological interventions for treating acute high altitude illness | |||||||
| Patient or population: people suffering from high altitude illness | |||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | ||
| Risk with various interventions | Risk with pharmacological interventions | ||||||
| All‐cause mortality | ‐ | ‐ | ‐ | ‐ | ‐ | Not reported | |
| Complete relief of AMS symptoms (12 to 16 hours after treatment) Scale used: Acute Mountain Sickness score (ranged from 0 to 9 (worse)) | Dexamethasone versus placebo | 0 per 1000 | 471 per 1000 | No estimable | 35 | ⊕⊕⊝⊝ | |
| Reduction in symptom score severity Time of measurement: 1 to 48 hours after treatment, end of treatment Scale of measurement: Self‐administered AMS questionnaires (ranged from 0 to 90 (worse)), AMS Symptom Questionnaire (ranged from 0 to 22 (worse)), Acute Mountain Sickness score (ranged from 0 to 9 (worse)), HAH Visual analogue score (VAS) (range no stated), Lake Louise Score (from 0 to 15 (worse)), | Acetazolamide versus placebo | Standardized Mean Difference 1.15 lower | 25 | ⊕⊕⊝⊝ | |||
| Dexamethasone versus placebo | Mean change from baseline: 0.4 units | Mean change from baseline: 4.1 units | Difference of 3.7 units (reported by trial authors) | 35 | ⊕⊕⊕⊝ | ||
| Gabapentin versus placebo | Mean VAS score: 4.75 | Mean VAS score: 2.92 | Not stated | 24 | ⊕⊕⊝⊝ | ||
| Magnesium versus placebo | Mean score: 10.3 units | Mean score: 9 units | Not stated | 25 | ⊕⊕⊝⊝ | ||
| Adverse effects Time of measurement: 1 to 48 hours after treatment, end of treatment Scale of measurement:not stated | Acetazolamide versus placebo | No reported | 0 per 1000 | Not estimable | 25 | ⊕⊕⊝⊝ | |
| Gabapentin versus placebo | 0 per 1000 | 0 per 1000 | Not stated | 24 | ⊕⊕⊝⊝ | ||
| Magnesium sulphate versus placebo | 77 per 1000 | 750 per 1000 | Not stated | 25 | ⊕⊕⊝⊝ | ||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||||
| GRADE Working Group grades of evidence | |||||||
| 1 Quality of evidence downgraded by two levels due to very serious risk of bias (multiple unclear biases and high risk of selective reporting bias) 2 Quality of evidence downgraded by two levels due to serious risk of bias (selection bias) and serious inconsistency (I² = 58%). 3 Quality of evidence downgraded by one level due to serious risk of bias (selection, performance and detection bias). 4 Quality of evidence downgraded by two levels due to serious risk of bias and serious imprecision. | |||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 AMS symptoms (standardized) Show forest plot | 2 | 25 | Std. Mean Difference (IV, Random, 95% CI) | ‐1.15 [‐2.56, 0.27] |

