Administración de suplementos de vitamina D a embarazadas
Resumen
Antecedentes
Se considera que la deficiencia o insuficiencia de vitamina D es frecuente en embarazadas. La administración de suplementos de vitamina D durante el embarazo se ha indicado como una intervención de protección contra los resultados gestacionales adversos.
Objetivos
Examinar si la administración a las embarazadas de suplementos de vitamina D por vía oral solos o en combinación con calcio u otras vitaminas y minerales puede mejorar de forma segura los resultados maternos y neonatales.
Métodos de búsqueda
Se hicieron búsquedas en el registro de ensayos del Grupo Cochrane de Embarazo y Parto (Cochrane Pregnancy and Childbirth Group) (23 febrero 2015), la International Clinical Trials Registry Platform (31 enero 2015), la Networked Digital Library of Theses and Dissertations (28 enero 2015) y también se estableció contacto con organizaciones relevantes (31 enero 2015).
Criterios de selección
Ensayos aleatorios y cuasialeatorios con asignación al azar a nivel individual o grupal, que evaluaron el efecto de la administración a las embarazadas de suplementos de vitamina D solos o en combinación con otros micronutrientes.
Obtención y análisis de los datos
Dos autores de la revisión de forma independiente i) evaluaron la elegibilidad de los estudios en función de los criterios de inclusión ii) extrajeron los datos de los estudios incluidos y iii) evaluaron el riesgo de sesgo de los estudios incluidos. Se verificó la exactitud de los datos. La calidad de las pruebas se evaluó con el enfoque GRADE.
Resultados principales
En esta revisión actualizada se incluyeron 15 ensayos que evaluaron a 2833 mujeres, se excluyeron 27 ensayos y 23 ensayos están aún en curso o no publicados. Nueve ensayos compararon los efectos de la vitamina D sola versus ninguna administración de suplementos o un placebo y seis ensayos compararon los efectos de la vitamina D y el calcio versus ninguna administración de suplementos. El riesgo de sesgo en la mayoría de los ensayos fue incierto y muchos estudios tuvieron un alto riesgo de sesgo para el cegamiento y las tasas de desgaste.
Vitamina D sola versus ninguna administración de suplementos o un placebo
Los datos de siete ensayos que incluyeron a 868 embarazadas muestran de forma consistentes que las pacientes que recibieron suplementos de vitamina D solos, particularmente de forma diaria, tuvieron mayor 25‐hidroxivitamina D que las que recibieron ninguna intervención o placebo, pero esta respuesta fue muy heterogénea. Además, los datos de dos ensayos que incluyeron a 219 embarazadas indican que las pacientes que recibieron suplementos de vitamina D pueden tener un riesgo menor de preeclampsia que las que recibieron ninguna intervención o placebo (8,9% versus 15,5%; cociente de riesgos [CR] 0,52; IC del 95%: 0,25 a 1,05; calidad baja). Los datos de dos ensayos que incluyeron a 219 embarazadas indican un riesgo similar de diabetes gestacional entre las que recibieron suplementos de vitamina D o ninguna intervención / placebo (CR 0,43; IC del 95%: 0,05 a 3,45; calidad muy baja). No hubo diferencias claras en los efectos adversos y solamente se informó un caso de síndrome nefrítico en el grupo control en un estudio (CR 0,17; IC del 95%: 0,01 a 4,06; un ensayo, 135 mujeres, calidad baja). Debido a la escasez de datos para este resultado, no se pueden establecer conclusiones firmes. No se informaron otros efectos adversos en ninguno de los otros estudios.
Con respecto a los resultados del lactante, los datos de tres ensayos que incluyeron a 477 embarazadas indican que la administración de suplementos de vitamina D durante el embarazo reduce el riesgo de parto prematuro en comparación con ninguna intervención o placebo (8,9% versus 15,5%; CR 0,36; IC del 95%: 0,14 a 0,93; calidad moderada). Los datos de tres ensayos con 493 pacientes indican que las que recibieron suplementos de vitamina D durante el embarazo con menor frecuencia tuvieron un recién nacido con un peso al nacer por debajo de 2500 g que las embarazas sin ninguna intervención o placebo (CR 0,40; IC del 95%: 0,24 a 0,67; calidad moderada).
En cuanto a otros resultados, no hubo diferencias claras en la cesárea (CR 0,95; IC del 95%: 0,69 a 1,31; dos ensayos; 312 mujeres); los mortinatos (CR 0,35; IC del 95%: 0,06 a 1,99; tres ensayos, 540 mujeres); o las muertes neonatales (CR 0,27; IC del 95%: 0,04 a 1,67; dos ensayos, 282 mujeres). Hubo alguna indicación de que la administración de suplementos de vitamina D aumenta la talla del lactante (diferencia de medias [DM] 0,70; IC del 95%: ‐0,02 a 1,43; cuatro ensayos, 638 lactantes) y el perímetro cefálico al nacer (DM 0,43; IC del 95%: 0,03 a 0,83; cuatro ensayos, 638 mujeres).
Vitamina D y calcio versus ninguna administración de suplementos o un placebo
Las embarazadas que recibieron vitamina D con calcio tuvieron un riesgo menor de preeclampsia que las que recibieron ninguna intervención (CR 0,51; IC del 95%: 0,32 a 0,80; tres ensayos; 1114 mujeres, calidad moderada), pero también un mayor riesgo de parto prematuro (CR 1,57; IC del 95%: 1,02 a 2,43, tres estudios, 798 mujeres, calidad moderada). La concentración de vitamina D materna al término, la diabetes gestacional, los efectos adversos y el bajo peso al nacer no se informaron en los ensayos o se informaron solamente en un estudio.
Conclusiones de los autores
Los estudios nuevos han aportado más pruebas sobre los efectos en las embarazadas de la administración de suplementos de vitamina D solos o con calcio sobre los resultados del embarazo. Las embarazadas que reciben suplementos de vitamina D a una dosis única o continua tienen un aumento en la 25‐hidroxivitamina D sérica al término y una posible reducción del riesgo de preeclampsia, bajo peso al nacer y parto prematuro. Sin embargo, cuando se combinan la vitamina D y el calcio aumenta el riesgo de parto prematuro. La importancia clínica del aumento de las concentraciones de 25‐hidroxivitamina D sérica todavía no está clara. Debido a lo anterior, estos resultados se deben interpretar con cuidado. Ningún estudio informó datos sobre los efectos adversos.
Las pruebas sobre si se deben administrar suplementos de vitamina D como parte de la atención prenatal habitual a todas las pacientes para mejorar los resultados maternos e infantiles todavía no están claras. Aunque hay alguna indicación de que la administración de suplementos de vitamina D podría reducir el riesgo de preeclampsia y aumentar la talla y el perímetro cefálico al nacer, se necesitan ensayos aleatorios rigurosos adicionales para confirmar estos efectos.
PICOs
Resumen en términos sencillos
Administración de suplementos de vitamina D a embarazadas
La vitamina D es producida por el cuerpo humano a partir de la exposición a la luz solar y también se puede obtener de alimentos como los aceites de hígado de pescado, los peces grasos, las setas, las yemas de huevo y el hígado. La vitamina D tiene muchas funciones en el cuerpo; ayuda a mantener la integridad ósea y la homeostasis del calcio.
Durante el embarazo se puede presentar deficiencia o insuficiencia de vitamina D. Se ha indicado que la administración de suplementos de vitamina D durante el embarazo mejora de forma segura los resultados del embarazo e infantiles. Esta revisión incluyó 15 ensayos controlados aleatorios con 2833 mujeres. Nueve ensayos compararon los efectos de la vitamina D sola con ninguna administración de suplementos o un placebo y seis ensayos compararon los efectos de la vitamina D y el calcio con ninguna administración de suplementos.
Los resultados muestran que la provisión de suplementos de vitamina D durante el embarazo mejora los niveles de vitamina D de las pacientes medidos por las concentraciones de 25‐hidroxivitamina D al término, y puede reducir el riesgo de parto prematuro (menos de 37 semanas de gestación), da lugar a un menor riesgo de hipertensión en las pacientes y reduce el riesgo de tener un recién nacido con bajo peso al nacer (menos de 2500 g). Sin embargo, al parecer cuando se combinan la vitamina D y el calcio aumenta el riesgo de parto prematuro. Los datos sobre los efectos adversos para la madre no se informaron bien.
La importancia clínica del aumento de los niveles de vitamina D de las pacientes no está clara y los resultados se deben interpretar con cuidado, ya que solamente unos pocos ensayos pequeños de calidad baja evaluaron estos resultados.
Con las pruebas disponibles, no está claro si la administración de suplementos de vitamina D se debe realizar como parte de la atención prenatal habitual para mejorar los resultados maternos e infantiles. Aunque hay alguna indicación de que la administración de suplementos de vitamina D podría reducir el riesgo de hipertensión y aumentar la talla y el perímetro cefálico al nacer, se necesitan ensayos aleatorios rigurosos adicionales para confirmar estos efectos. Actualmente, el número de ensayos de alta calidad con tamaños grandes de la muestra y resultados informados es demasiado limitado para establecer conclusiones definitivas sobre la utilidad y la seguridad.
Conclusiones de los autores
Summary of findings
| Population: women during pregnancy | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk with no treatment/placebo (no vitamins or minerals) | Risk with vitamin D alone | |||||
| Pre‐eclampsia (ALL) | Study population | RR 0.52 | 219 | ⊕⊕⊝⊝ | ||
| 155 per 1000 | 80 per 1000 | |||||
| Moderate | ||||||
| 124 per 1000 | 64 per 1000 | |||||
| Gestational diabetes (ALL) | Study population | RR 0.43 | 219 | ⊕⊝⊝⊝ | ||
| 24 per 1000 | 10 per 1000 | |||||
| Moderate | ||||||
| 27 per 1000 | 12 per 1000 | |||||
| Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (ALL) | The mean maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (ALL) in the intervention group was 47.24 higher (35.17 to 59.31 higher) | 868 | ⊕⊕⊝⊝ | |||
| Adverse effects | Study population | RR 0.17 (0.01 to 4.06) | 135 (1 RCT) | ⊕⊕⊝⊝ | ||
| 22 per 1000 | 4 per 1000 (0 to 90) | |||||
| Preterm birth (less than 37 weeks' gestation) (ALL) | Study population | RR 0.36 | 477 | ⊕⊕⊕⊝ | ||
| 99 per 1000 | 36 per 1000 | |||||
| Moderate | ||||||
| 46 per 1000 | 17 per 1000 | |||||
| Low birthweight (less than 2500 g) (ALL) | Study population | RR 0.40 | 493 | ⊕⊕⊕⊝ | ||
| 199 per 1000 | 80 per 1000 | |||||
| Moderate | ||||||
| 193 per 1000 | 77 per 1000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Most studies contributing data had design limitations (high risk for allocation concealment and attrition bias). 2 Wide confidence interval crossing the line of no effect. 3 Wide confidence interval crossing the line of no effect & few events. 4 Statistical heterogeneity (I² > 60%). Considerable variation in size of effect. | ||||||
| Population: women during pregnancy | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk with no treatment/placebo (no vitamin or minerals) | Risk with vitamin D + calcium | |||||
| Pre‐eclampsia (ALL) | Study population | RR 0.51 | 1114 | ⊕⊕⊕⊝ | ||
| 93 per 1000 | 48 per 1000 | |||||
| Moderate | ||||||
| 90 per 1000 | 46 per 1000 | |||||
| Gestational diabetes (ALL) | Study population | RR 0.33 | 54 | ⊕⊕⊝⊝ | ||
| 37 per 1000 | 12 per 1000 | |||||
| Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (ALL) | (0 studies) | No trial assessed this outcome. | ||||
| Adverse effects | (0 studies) | No trial assessed this outcome. | ||||
| Preterm birth (less than 37 weeks' gestation) (ALL) | Study population | RR 1.57 | 798 | ⊕⊕⊕⊝ | **Because there were zero events in some of the groups in two out of three of the included trials, GRADEpro GDT did not produce corresponding risks for a moderate risk population. | |
| 73 per 1000 | 114 per 1000 | |||||
| Moderate | ||||||
| ** | ** | |||||
| Low birthweight (less than 2500 g) (ALL) | Study population | Not estimable | (0 studies) | No trial assessed this outcome. | ||
| Not pooled | Not pooled | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Most studies contributing data had design limitations (selection bias was unclear and high risk of attrition bias) 2 Wide confidence interval crossing the line of no effect, few events & small sample size. | ||||||
Antecedentes
Descripción de la afección
Metabolismo de la vitamina D
La vitamina D es una vitamina soluble en grasas que proviene principalmente de la exposición a la luz solar, y se encuentra de forma natural solamente en unos pocos alimentos, como los aceites de hígado de pescado, los peces grasos, las setas, las yemas de huevos y el hígado (Holick 2007a; Holick 2008). Hay dos formas fisiológicamente activas de la vitamina D, llamadas en conjunto calciferol: D2 y D3. . La vitamina D2 (también llamada ergocalciferol) se sintetiza a partir de fuentes vegetales, mientras que la vitamina D3 (también llamada colecalciferol) se produce en el tejido subcutáneo de los seres humanos a partir de 7‐dehidrocolecalciferol con la exposición a la radiación con luz ultravioleta B (UVB) (DeLuca 2004). La vitamina D en los suplementos se encuentra como vitamina D2 o D3. La última puede ser tres veces más eficaz que la vitamina D2 para elevar las concentraciones séricas de vitamina D y mantener esos niveles por un tiempo más largo, en particular durante los meses de invierno; además, sus metabolitos tienen una afinidad superior por las proteínas que se unen a la vitamina D en el plasma(Armas 2004; Logan 2013; McCullough 2007). Como la vitamina D tiene una vida media corta, la ingesta suficiente de vitamina D es necesaria para asegurar que se mantengan los niveles circulantes.
Las formas D2 y D3 comparten un metabolismo similar. Primero son hidroxiladas en el hígado para formar 25 hidroxivitamina D (25[OH]D o calcidiol) y luego en el riñón a 1,25 dihidroxilo vitamina D (1,25 [OH]2 D o calcitriol) en respuesta a los niveles de la hormona paratiroidea (PTH). El calcitriol se considera una prehormona importante y sus metabolitos activos participan en procesos metabólicos que incluyen la integridad ósea y la homeostasis del calcio (Wagner 2008).
Los sitios principales de acción de la vitamina D incluyen la piel, el intestino, los huesos, la glándula paratiroidea, el sistema inmunológico y el páncreas, así como el intestino delgado y el colon en el feto humano (Theodoropoulos 2003). Además, la vitamina D ayuda a mantener los niveles normales de la glucosa en sangre por la unión y la activación del receptor de vitamina D en las células beta pancreáticas, y al regular la liberación de insulina en respuesta al nivel de glucosa circulante (Clifton‐Bligh 2008; Maghbooli 2008; Palomer 2008; Xuan 2013). La vitamina D también afecta indirectamente al metabolismo de la glucosa mediante la regulación de la homeostasis del calcio (Xuan 2013).
Hay una relación única entre la vitamina D y el calcio. La PTH se encarga de elevar la concentración de calcio en sangre mediante la resorción ósea, mientras el calcitriol inhibe la PTH y permite un aumento de la concentración sérica del calcio de fuentes diferentes del hueso. En presencia de calcitriol la absorción renal e intestinal de calcio y fósforo aumenta, lo que da lugar a un mejor estado del calcio.
Estado de la vitamina D
El calcidiol sérico o la 25‐hidroxivitamina D se puede utilizar para evaluar el estado de la vitamina D, ya que refleja la suma de la vitamina D producida cutáneamente y la que se obtiene de los alimentos y los suplementos(Jones 2008). Este metabolito es difícil de medir, con variaciones grandes entre los métodos y entre los laboratorios, incluso cuando se utilizan los mismos métodos, lo que se puede explicar por las diferencias en las muestras pretratamiento o el sistema disolvente de extracción utilizado (Hollis 2004; Lankes 2015).
Recientemente, el Institute of Medicine definió el estado suficiente de la vitamina D como tener concentraciones séricas de 25‐hidroxivitamina D mayores de 50 nmol/l (o 20 ng/ml) en la población general y las embarazadas (Institute of Medicine 2010). Algunos investigadores proponen que las concentraciones alrededor de 80 nmol/l (32 ng/ml) son óptimas, ya que suprimen los niveles de PTH y dan lugar a una mayor absorción de calcio y a una mayor masa ósea, lo que reduce las tasas de pérdida ósea, las caídas y las fracturas (Dawson‐Hughes 2005; Dawson‐Hughes 2008). No está claro si estos niveles más altos propuestos para los adultos no embarazados también son adecuados para las embarazadas.
El estado de vitamina D se afecta por factores que regulan su producción en la piel (es decir, la pigmentación de la piel, la latitud, los códigos de vestimenta, la estación, el envejecimiento, el uso de filtros solares y la contaminación del aire) y por factores que afectan su absorción o metabolismo (Holick 2007b; Maghbooli 2007). La melanina actúa como un filtro para los rayos ultravioletas (UV), por lo que reduce la producción de vitamina D por la piel. Las poblaciones hispanas y negras en los Estados Unidos pueden tener un contenido de melanina mayor y por lo tanto una reducción de la fotosíntesis (síntesis endógena debido a la exposición a la luz solar) de vitamina D (Clemens 1982), que explica las variaciones en la concentración de vitamina D entre grupos étnicos que viven en las mismas zonas geográficas (Brooke 1980; Egan 2008; Ganji 2012; Matsuoka 1991; Nesby‐O'Dell 2002; Rockell 2005). El fototipo de la piel de un individuo refleja el grado de quemadura solar versus el bronceado posterior después de una exposición inicial moderada al sol luego de un período prolongado de poca o ninguna exposición (Gilchrest 2008). Los fototipos I y II tienen una fotosíntesis rápida de vitamina D después de una dosis eritemática mínima (DEM). Por el contrario, el prototipo VI tiene una fotosíntesis pequeña de vitamina después de la misma DEM (Clemens 1982). También se ha mostrado que las diferencias en la latitud influyen en la concentración de vitamina D, y los individuos de los países en latitudes altas y bajas tienen niveles inferiores de vitamina D. La importancia de los rayos ultravioletas se muestra aún más por la variación estacional en la concentración de vitamina D entre el verano y el invierno, con niveles más altos durante el verano en comparación con los meses de invierno (Holick 2007b; Levis 2005). El metabolismo de la vitamina D también está afectado en los individuos con obesidad, ya que la vitamina D se deposita en las reservas de grasas del cuerpo, haciéndola menos biodisponible(Arunabh 2003). Más recientemente, este estado bajo de vitamina D en los individuos con obesidad se ha explicado por una dilución volumétrica simple de la vitamina D en la masa grasa (Drincic 2012), lo que da lugar a una prevalencia mayor de niveles bajos de 25‐hidroxivitamina D y estos son más prevalentes entre los individuos con sobrepeso u obesidad en comparación con los individuos de peso normal (Vilarrasa 2007; Vimaleswaran 2013; Wortsman 2000). En el mismo contexto, la actividad sedentaria también se asocia con niveles de vitamina D bajos, ya que puede estar vinculado a la disminución de la exposición a la luz solar Ohta 2009).
Magnitud de la deficiencia de vitamina D
La deficiencia de vitamina D (DVD) puede ser un problema de salud frecuente en todo el mundo (Bandeira 2006; Palacios 2014; van Schoor 2011). Una revisión reciente encontró una alta prevalencia del estado bajo de vitamina D en los lactantes, los niños, los adolescentes, los adultos y las personas de edad avanzada en todo el mundo, incluso en países con exposición al sol todo el año (Palacios 2014). La prevalencia más alta informada se encontró en el Medio Oriente, en particular en las niñas y las mujeres, aunque hay una falta de datos en la mayoría de los países de América del Sur y África.
En el embarazo, la deficiencia de vitamina D y la insuficiencia de vitamina D también son frecuentes. Una revisión reciente incluyó 17 estudios en embarazadas y mujeres que lactan (dos en América, seis en Europa, uno en África, siete en Asia, uno en Oceanía) (Palacios 2014). Se encontró un estado bajo de vitamina D (definido como concentraciones < 50 nmol/l) en el 33% de las embarazadas de EE.UU. y en el 24% de las canadienses, respectivamente. En Europa, la prevalencia del estado bajo de vitamina D fue del 45% en Bélgica, del 35% en el Reino Unido, del 44% en los Países Bajos, del 20% en España y del 77% en Alemania. Además, la prevalencia de la deficiencia de vitamina D (definida como < 30 nmol/l) fue del 12% en Bélgica, del 4% en Inglaterra y del 23% en los Países Bajos. El único estudio informado en África informó una prevalencia muy baja del estado bajo de vitamina D (1%) en una muestra de 139 embarazadas en Tanzania. En Asia, la prevalencia del estado bajo de vitamina D en las embarazadas fue muy alta: 90% en Turquía, 67% en Irán, el 72% en Pakistán, el 70% a 83% en Kuwait, el 96% en la India y el 69% en China. La prevalencia de deficiencia de vitamina D también fue muy alta: 50% en Turquía, 45% en Pakistán, 38% a 41% en Kuwait y el 60% en la India. En Australia se encontró un estado bajo de vitamina D en el 48% y se encontró deficiencia de vitamina D en el 15% de las embarazadas.
La variación estacional aumenta el riesgo de DVD en el embarazo, con una mayor prevalencia de DVD durante los meses de invierno en comparación con los meses de verano(Nicolaidou 2006; O'Riordan 2008). Las diferencias en la latitud también han mostrado influir en la concentración de vitamina D en una mayoría de las embarazadas(Sloka 2009).
Estado de la vitamina D materna y resultados de salud
El estado de la vitamina D durante el embarazo es la etapa más importante del ciclo de vida, ya que el feto depende completamente de esta fuente durante este período para su desarrollo. Durante el embarazo, la 1,25‐dihidroxivitamina D aumenta de forma temprana durante el embarazo y este aumento continúa hasta el parto (Moller 2013). Este aumento grande de la 1,25‐dihidroxivitamina D parece ser dependiente de los niveles disponibles de 25‐dihidroxivitamina D pero independiente del metabolismo del calcio, que es una característica única del embarazo que permite dichos niveles altos de 1,25‐dihidroxivitamina D (Pludowski 2013). Por lo tanto, mantener niveles suficientemente altos de 25‐dihidroxivitamina D es fundamental para mantener niveles elevados de 1,25‐dihidroxivitamina D importantes durante el embarazo. No obstante, dichos niveles están todavía por determinar, pero varios estudios han mostrado que el estado de la vitamina D materna se asocia significativamente con el estado de la vitamina D fetal y neonatal (El Koumi 2013; Sachan 2005) y ese estado de la vitamina D materna se asocia con resultados de salud durante el embarazo y el desarrollo neonatal e infantil. Estas asociaciones se describirán a continuación.
Estado de la vitamina D y trastornos hipertensivos durante el embarazo
La deficiencia de vitamina D materna en el embarazo se ha asociado con un mayor riesgo de preeclampsia (hipertensión gestacional de nueva aparición y proteinuria después de las 20 semanas de gestación), una afección asociada con un aumento de la morbilidad y la mortalidad materna y perinatal (Bodnar 2007; Holick 2008; Li 2000b; MacKay 2001; Xiong 1999). Un metanálisis reciente que incluyó ocho estudios encontró una asociación significativa entre la deficiencia de vitamina D y el riesgo de preeclampsia, que fue más evidente en las que la deficiencia de vitamina D se definió como 25(OH)D 50 nmol/l (20 ng/ml) y en las de los EE.UU.(Tabesh 2013). De manera similar, otro metanálisis que incluyó 31 estudios también encontró un riesgo 78% mayor de preeclampsia en las embarazadas con estado bajo de vitamina D (odds ratio [OR] 1,79; intervalo de confianza [IC] del 95%: 1,25 a 2,58) (Aghajafari 2013).
Las pacientes con preeclampsia tienen concentraciones inferiores de 25‐hidroxivitamina D en comparación con las embarazadas con presión arterial normal (Diaz 2002; Frenkel 1991; Halhali 1995; Halhali 2000; Tolaymat 1994). Los bajos niveles de calcio urinario (hipocalciuria) en las pacientes con preeclampsia se pueden deber a una reducción en la absorción intestinal de calcio deteriorada por los bajos niveles de vitamina D (August 1992; Halhali 1995). Además, la preeclampsia y la deficiencia de vitamina D se asocian directa e indirectamente a través de mecanismos biológicos que incluyen la disfunción inmunitaria, la implantación placentaria, la angiogénesis anormal, la inflamación excesiva y la hipertensión (Bodnar 2007; Cardus 2006; Evans 2004; Hewison 1992; Li 2002). La vitamina D puede influir en el desarrollo placentario temprano y, por lo tanto, en el desarrollo de preeclampsia a través de su función en la regulación y la expresión de los genes; sin embargo, se necesitan más estudios para confirmarlo.
Estado de la vitamina D y otras afecciones maternas
La deficiencia de vitamina D materna en el primer trimestre de embarazo se ha asociado con un riesgo elevado de diabetes mellitus gestacional (Farrant 2009; Zhang 2008). Un metanálisis reciente de 31 estudios observacionales encontró que los niveles de vitamina D bajos aumentaron el riesgo de diabetes gestacional en el 49% (OR 1,49; IC del 95%: 1,18 a 1,89) (Aghajafari 2013). Resultados similares se encontraron en otro metanálisis de 24 estudios observacionales (Wei 2013). El control deficiente de la diabetes materna en el primer trimestre de embarazo se correlaciona inversamente con un contenido mineral óseo bajo en los lactantes, como con el estado bajo de la vitamina D materna (Namgunga 2003). La DVD puede provocar un recambio óseo alto, pérdida ósea, osteomalacia (reblandecimiento de los huesos) y miopatía (debilidad muscular) en la madre, además de DVD neonatal e infantil (El Koumi 2013; Glerup 2000; Lips 2001).
Un estado adecuado de vitamina D también puede proteger contra otros resultados adversos en el embarazo. Por ejemplo, la deficiencia de vitamina D materna se ha vinculado con la cesárea(Merewood 2009; Scholl 2012), pero los mecanismos involucrados no están claros. Se ha indicado que la deficiencia de vitamina D durante el embarazo puede reducir la fuerza y el control muscular pelviano (Scholl 2012), pero es necesario confirmarlo.
Las concentraciones maternas prenatales y perinatales bajas de vitamina D pueden afectar la función de otros tejidos, lo que provoca un riesgo mayor de esclerosis múltiple, cáncer, diabetes mellitus dependiente de la insulina y esquizofrenia en etapas posteriores de la vida (McGrath 2001).
Estado de la vitamina D y parto prematuro y bajo peso al nacer
Se ha informado una posible asociación inversa entre el estado de la vitamina D materna y el parto prematuro (menos de 37 semanas de gestación) (Dawodu 2011; Morley 2006). Por el contrario, no todos los estudios muestran asociaciones significativas entre los niveles de calcidiol materno y cualquier medida del tamaño del niño al nacer o durante los primeros meses de vida (Bodnar 2010; Farrant 2009; Gale 2008; Morley 2006).
Un metanálisis reciente de 24 estudios observacionales confirmó la asociación entre los niveles bajos de vitamina D (< 50 nmol/l) y un aumento en el riesgo de parto prematuro (OR 1,58; IC del 95%: 1,08 a 2,31) (Wei 2013). Además, dos metanálisis también encontraron asociaciones significativas entre el estado bajo de la vitamina D y un recién nacido pequeño para la edad gestacional(Theodoratou 2014; Wei 2013). Con respecto al peso al nacer, un metanálisis reciente que incluyó tres estudios observacionales encontró una asociación positiva débil entre el estado de la vitamina D materna y el peso al nacer después del ajuste por posibles factores de confusión (Harvey 2014), pero otro metanálisis que incluyó cuatro estudios observacionales encontró una asociación significativa entre estas variables (Theodoratou 2014).
No hay mucha información sobre el estado de la vitamina D materna y el bajo peso al nacer o el parto prematuro en los niños nacidos de embarazadas con infección por el VIH (Mehta 2009). Los estudios han informado una alta prevalencia de la deficiencia de vitamina D entre las embarazadas con infección por el VIH (Eckard 2013; Mave 2012).
Estado de la vitamina D y crecimiento posnatal
Algunos estudios observacionales indican que los niveles de vitamina D durante el embarazo influyen en el desarrollo óseo fetal y el crecimiento de los niños (Bodnar 2010; Brooke 1980; Ioannou 2012; Mahon 2010; Morley 2006). Sin embargo, hay información inconsistente entre el estado de la vitamina D materna y el perímetro cefálico, ya que una revisión sistemática reciente de estudios observacionales encontró una asociación positiva no significativa en cinco estudios pero también una asociación inversa no significativa en cuatro estudios entre estos resultados (Harvey 2014). Sin embargo, un estudio encontró que el perímetro cefálico en niños de nueve años de edad se asoció significativamente con los niveles de calcidiol materno (Gale 2008). Con respecto al estado de la vitamina D materna y la masa ósea de los lactantes, también hay resultados inconsistentes (Akcakus 2006; Harvey 2014; Javaid 2006; Viljakainen 2010).
No está claro si la deficiencia de vitamina D materna provoca raquitismo neonatal, ya que en general el raquitismo se identifica posteriormente en la niñez. Estudios antiguos indican un posible riesgo de raquitismo neonatal en las descendencias de pacientes con osteomalacia, reblandecimiento anormal del hueso por deficiencia de fósforo, calcio o vitamina D (Ford 1973). Estudios más recientes han encontrado que la deficiencia de vitamina D (concentraciones séricas inferiores de 25 nmol/l) se identificó en el 92% de los niños árabes con raquitismo y el 97% de las madres en comparación con el 22% de niños sin raquitismo y el 52% de las madres (Dawodu 2005). Se encontró una correlación positiva entre los niveles de vitamina D maternos e infantiles.
Además, los análisis que utilizaron datos de embarazadas que participaron en la Southampton Women's Survey, un estudio longitudinal prospectivo, encontraron en los fetos de las madres con estado bajo de vitamina D una mayor área transversal metafisaria femoral y un mayor índice de separación femoral a las 19 y 34 semanas de gestación (Mahon 2010) y una asociación significativa entre el volumen del fémur fetal y el estado de la vitamina D (Ioannou 2012), lo que ha indicado que es posible que esté relacionado con el desarrollo temprano de raquitismo (Harvey 2014).
Estado de la vitamina D y respuesta inmunitaria
La vitamina D tiene efectos directos sobre los sistemas inmunológicos adaptativos e innatos (Miller 2010; Walker 2009). En los niños, la insuficiencia de vitamina D está vinculada a enfermedades autoinmunitarias como diabetes mellitus tipo 1, esclerosis múltiple, alergias y enfermedades atópicas (Bener 2009; Miller 2010; Pierrot‐Deseilligny 2010). Diversos estudios también han mostrado que la deficiencia de vitamina D se asocia firmemente con tuberculosis, neumonía y fibrosis quística (Chocano‐Bedoya 2009; Hall 2010; Nnoaham 2008; Williams 2008) y la deprivación de vitamina D prenatal y perinatal quizás influya en la morbilidad respiratoria en los primeros años de vida, ya que esta vitamina es importante para el crecimiento y desarrollo de los pulmones (Devereux 2007; Litonjua 2009).
La vitamina D puede tener efectos positivos en el sistema inmunológico por el aumento en la producción de péptidos antimicrobianos por los macrófagos y las células endoteliales(Wang 2004), lo que puede desactivar los virus y suprimir la inflamación (Cantorna 2008), y posteriormente reducir la gravedad de las infecciones.
Toxicidad de la vitamina D
El exceso de vitamina D provoca hipercalcemia (niveles de calcio de 10,5 mg/dl o más) e hipercalciuria (excreción urinaria de calcio que excede los 250 mg/día en las mujeres), que se asocian con cálculos renales y urinarios (Heaney 2008). La toxicidad en adultos aparece generalmente a dosis de vitamina D mayores de 10 000 unidades internacionales (UI)/d (250 µg/d), aunque la mayoría de las pruebas se basa en exposiciones a corto plazo (menos de seis meses)(Hathcock 2007; Heaney 2008; Institute of Medicine 2010; Vieth 1999). Los suplementos de dosis única que proporcionan 7,5 mg (300 000 UI) o más también pueden ser perjudiciales (Roth 2011a).
La posibilidad de teratogénesis (defectos congénitos) inducida por la vitamina D y los efectos adversos en la descendencia (p.ej. restricción del crecimiento, osificación retardada, hipoplasia craneofacial) se han indicado en algunos estudios en ratas y conejos (Ariyuki 1987; Chan 1979; Friedman 1969; Ornoy 1968; Ornoy 1969). Sin embargo, hay considerables limitaciones en la extrapolación de dichos resultados a los seres humanos, ya que supuestamente no han ocurrido efectos adversos fetales después de la ingestión materna de dosis de mantenimiento tan altas como 5 mg (200 000 UI) de vitamina D por día. En general, los estudios realizados en animales y en seres humanos indican que es poco probable que ocurra un exceso fetal de metabolitos de vitamina D cuando las concentraciones maternas están dentro de un rango normal (Roth 2011a).
Descripción de la intervención
Algunas organizaciones sanitarias recomiendan la administración de suplementos de vitamina D durante el embarazo y la lactancia. Sin embargo, hay variaciones en la dosis recomendada para la administración de suplementos, con un rango entre 200 y 400 UI/d (5 a 10 µg/d) (Canadian Paediatric Society 2007; UK Department of Health 2009). La American Academy of Pediatrics (Wagner 2008) indica que los profesionales sanitarios que prestan atención obstétrica deben considerar monitorizar el estado de la vitamina D materna mediante la medición de las concentraciones en las embarazadas.
Sin embargo, hay controversia con respecto a los niveles de 25‐hidroxivitamina D que se consideran suficientes u óptimos para la salud general. El Institute of Medicine de los EE.UU. ha determinado que concentraciones mayores de 50 nmol/l o 20 ng/ml son suficientes según los estudios actuales disponibles (Institute of Medicine 2010), aunque muchos investigadores consideran que los niveles óptimos deben ser mayores (mayor de 75 nmol/l o 30 ng/ml) (Dawson‐Hughes 2005; Hollick 2009). Se ha indicado que quizás sea necesaria una dosis suplementaria de vitamina D de 1000 a 1600 UI (25 a 40 µg/d) para lograr el nivel óptimo de esta vitamina en el cuerpo (Dawson‐Hughes 2005). Esta dosis se espera que eleve la 25‐hidroxivitamina D sérica en 1,2 nmol/l por cada μg (40 UI) de vitamina D3 administrado por vía oral a individuos con niveles bajos de 25‐hidroxivitamina D; los que tienen concentraciones iniciales mayores tendrían incrementos más pequeños con la misma dosis(Dawson‐Hughes 2005). Sin embargo, la dosis de vitamina D necesaria para lograr un efecto durante el embarazo para prevenir o tratar la deficiencia de vitamina D no está clara. Algunos investigadores han indicado que pueden ser necesarias dosis de alrededor de 1000 UI/d para que las embarazadas mantengan una concentración sanguínea de vitamina D de más de 50 nmol/L (20 ng/mL)(Heaney 2003; Hollis 2004; Hollis 2007; Vieth 2001). Otros han indicado proporcionar vitamina D como dosis semanales de 5000 UI (125 μg/wk)(Utiger 1998) o una dosis única de 200 000 UI (5 mg) o mayor (Mallet 1986; Sahu 2009; Yu 2009).
Debido a que la vitamina D también puede ser sintetizada por la piel con la exposición a la luz solar, se ha recomendado un aumento eventual de la exposición al sol para alcanzar concentraciones séricas óptimas (Holick 2002). Sin embargo, como la radiación ultravioleta excesiva es un carcinógeno, quizás valga la pena obtener vitamina D adicional de los alimentos o los suplementos.
De qué manera podría funcionar la intervención
Los suplementos de vitamina D mejoran el estado de la vitamina D materna durante el embarazo (Delvin 1986; Yu 2009), lo que a su vez puede tener una influencia directa sobre el suministro fetal y neonatal de vitamina D(Brooke 1980). Se ha indicado el posible efecto de la administración gestacional de suplementos de vitamina D en la prevención del parto prematuro (menos de 37 semanas de gestación) y del bajo peso al nacer (menos de 2500 g) (Maxwell 1981), aunque hay información limitada sobre el efecto beneficioso adicional de la administración de suplementos de vitamina D sobre otras intervenciones nutritivas durante el embarazo como la administración de suplementos de hierro y ácido fólico en el riesgo del bajo peso al nacer (Christian 2003). También hay un posible efecto de la administración materna de suplementos de vitamina D sobre el crecimiento neonatal (Marya 1988). La administración de suplementos de vitamina D durante el embarazo puede ser necesaria para asegurar las concentraciones suficientes de vitamina D en la leche materna durante la lactancia (Butte 2002).
Por qué es importante realizar esta revisión
Esta revisión actualiza una revisión Cochrane anterior (De‐Regil 2012) e incorpora nuevas pruebas sobre los efectos y la seguridad de la administración oral de suplementos de vitamina D en el embarazo para el bienestar de la madre y el recién nacido.
Objetivos
Examinar si la administración a las embarazadas de suplementos de vitamina D solos por vía oral o en combinación con calcio u otras vitaminas y minerales puede mejorar de forma segura los resultados maternos y neonatales.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se planificó incluir ensayos aleatorios y cuasialeatorios con asignación al azar a nivel individual o grupal, pero solamente se encontraron ensayos controlados aleatorios con asignación al azar individual. En este metanálisis no se incluyeron los ensayos cruzados (crossover) u otros diseños observacionales (p.ej. estudios de cohortes o estudios de casos y controles) pero dichas pruebas se consideraron en la discusión, cuando fue relevante.
Tipos de participantes
Embarazadas de cualquier edad gestacional o cronológica, paridad (número de partos) y número de fetos. Se excluyeron las embarazadas con afecciones preexistentes (es decir, diabetes gestacional).
Tipos de intervenciones
Administración de suplementos de vitamina D durante el embarazo independientemente de la dosis, la duración o momento de comienzo de la administración de suplementos. Se incluyeron los ensayos que estudiaron la vitamina D sola o en combinación con otros micronutrientes siempre que los grupos control y de intervención fueran tratados de igual manera. Se evaluaron especialmente las siguientes comparaciones:
-
suplementos de vitamina D oral solos versus ninguna intervención / placebo (ninguna vitamina o minerales);
-
vitamina D oral + suplementos de calcio versus ninguna intervención / placebo (ninguna vitamina o minerales);
-
vitamina D oral + suplementos de calcio versus suplementos de calcio oral (pero ninguna vitamina D);
-
vitamina D oral + calcio + suplementos de otras vitaminas y minerales versus calcio oral + suplementos de otras vitaminas y minerales (pero ninguna vitamina D);
-
vitamina D oral + calcio + suplementos de otras vitaminas y minerales versus suplementos de otras vitaminas y minerales (pero ninguna vitamina D + calcio).
Se planificó excluir los estudios donde la vitamina D se proporcionó por inyección.
Tipos de medida de resultado
Resultados prenatales clínicos y de laboratorio maternos y resultados clínicos y de laboratorio de los lactantes, como se describe a continuación.
Resultados primarios
Maternas
-
Preeclampsia (como la definieron los autores de los ensayos).
-
Diabetes gestacional (como la definieron los autores de los ensayos).
-
Concentración de vitamina D al término (25‐hidroxivitamina D en nmol/l).
-
Efectos adversos (p.ej. hipercalcemia, cálculos renales).
Del lactante
-
Parto prematuro (menos de 37 semanas de gestación).
-
Bajo peso al nacer (menos de 2500 g).
Resultados secundarios
Maternas
-
Intolerancia a la glucosa (como la definieron los autores de los ensayos).
-
Cesárea.
-
Hipertensión gestacional (como la definieron los autores de los ensayos).
-
Muerte materna (muerte durante el embarazo o dentro de los 42 días de finalizado el embarazo).
Del lactante
-
Talla al nacer (cm).
-
Perímetro cefálico al nacer (cm).
-
Peso al nacer (g).
-
Ingreso a cuidados especiales (incluidos cuidados intensivos) durante el período neonatal (en el transcurso de 28 días después del parto).
-
Mortinato (como lo definieron los autores de los ensayos).
-
Muerte neonatal (en el transcurso de 28 días después del parto).
-
Puntuación de Apgar menor a siete a los cinco minutos.
-
Infección neonatal (p.ej. infecciones respiratorias en el transcurso de 28 días después del parto).
-
Parto muy prematuro (de menos de 32 semanas de gestación).
Results
Description of studies
Results of the search
The updated search of the Cochrane Pregnancy and Childbirth Group's Trials Register found 48 reports for possible inclusion and the additional search strategy identified 17 references. After removal of duplicates, there were 101 reports (65 studies) overall in this updated to assess.
We now include 15 trials (Asemi 2012; Asemi 2013a; Brooke 1980; Delvin 1986; Diogenes 2013; Grant 2013; Li 2000a; Mallet 1986; Marya 1987; Marya 1988; Mazurkevich 2013; Roth 2010; Sablok 2015; Taherian 2002; Yu 2008) involving 2833 women. We excluded 27 trials and we have identified 23 ongoing or unpublished trials (Bhatia 2012b; Benson 2009; Bhutta 2011; Bisgaard 2009; Ghasemi 2014; Goldring 2010; Habib 2010; Hacker 2010; Harvey 2012; Jannati 2012; Jelsma 2013; Judkins 2011; Kachhawa 2014; Lalooha 2012; Lindqvist 2010; McLean 2012; Mirghafourvand 2013, Mozzafari 2010; Nausheen 2014; Rasmussen 2009Roth 2013b; Simsek 2011; Wagner 2013). (See: Figure 1).
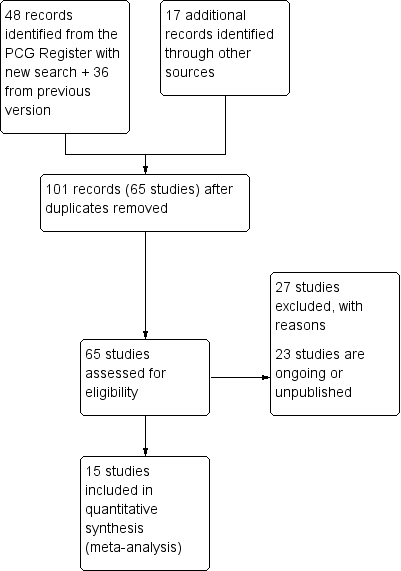
Study flow diagram for this update
Details of these studies are provided in: Characteristics of included studies; Characteristics of excluded studies; Studies awaiting classification tables.
Included studies
Settings
All the studies included in this review were carried out in the 1980s and during the 2000s. Trials were conducted in Bangladesh (Roth 2010), Brasil (Diogenes 2013), China (Li 2000a), France (Delvin 1986; Mallet 1986), India (Marya 1987; Marya 1988; Sablok 2015), Iran (Asemi 2012; Asemi 2013a; Taherian 2002), New Zealand (Grant 2013), Russia (Mazurkevich 2013) and the United Kingdom (Brooke 1980; Yu 2008).
Latitude
The latitude of the settings was north of the Tropic of Cancer, also referred to as the Northern tropic in 13 trials (Asemi 2012; Asemi 2013a; Brooke 1980; Delvin 1986; Li 2000a; Mallet 1986; Marya 1987; Marya 1988; Mazurkevich 2013; Roth 2010; Sablok 2015; Taherian 2002; Yu 2008). One trial was conducted between the Tropics of Cancer and Capricorn (Grant 2013), and one study was conducted just were the tropic of Capricorn lies (Diogenes 2013).
Seasonality
The seasons varied among studies with some trials occurring during the winter‐spring period (Delvin 1986); winter (Mallet 1986); summer (Roth 2010; Yu 2008); spring‐summer period (Asemi 2013a), or mixed/unknown/unreported in five trials (Asemi 2012; Li 2000a; Marya 1987; Marya 1988; Mazurkevich 2013; Taherian 2002). Four trials were carried out in different seasons to avoid distortion of the results due to seasonal variation in sunlight hours (Brooke 1980; Diogenes 2013; Grant 2013; Sablok 2015).
Participants
The sample size from all the studies was small and ranged between 40 (Delvin 1986) and 400 women (Marya 1987). In all the studies, women were recruited and received the supplements at 20 or more weeks' gestation (Asemi 2012; Asemi 2013a; Brooke 1980; Delvin 1986; Diogenes 2013; Grant 2013; Li 2000a; Mallet 1986; Marya 1987; Marya 1988; Mazurkevich 2013; Roth 2010; Sablok 2015; Taherian 2002; Yu 2008).
Pre‐gestational body mass index (kg/m2)
Pre‐gestational body mass index of the participants was reported only in five trials (Asemi 2012; Asemi 2013a; Diogenes 2013; Sablok 2015; Taherian 2002). The rest of the trials did not report this (Brooke 1980; Delvin 1986; Grant 2013; Li 2000a; Mallet 1986; Marya 1987; Marya 1988; Mazurkevich 2013; Roth 2010; Yu 2008). One study stratified for pre intervention BMI (in kg/m2; less than 30 and 30 or more) before randomisation (Asemi 2013a).
Skin pigmentation based on Fitzpatrick skin tone chart
In one trial (Brooke 1980), women were first‐generation immigrants mostly from India, Pakistan, Bangladesh, Sri Lanka, Mauritius and east Africa. One trial described the participants as being Indian, Asian, Middle Eastern, Black or Caucasian (Yu 2008), and another trial described the participants as white women (Mallet 1986). The trial by Asemi 2012 reported that women were Iranian and the study by Diogenes 2013 reported that women most were mixed blacks and whites. One trial (Grant 2013) was carried out among Pacific, European and Maori women. The remaining trials did not report the characteristics of the participants in terms of ethnicity or skin pigmentation (Asemi 2013a; Delvin 1986; Li 2000a; Marya 1987; Marya 1988; Mazurkevich 2013; Roth 2010; Sablok 2015; Taherian 2002). None used the Fitzpatrick skin tone chart.
Interventions
Nine trials compared provision of oral vitamin D supplement in comparison with placebo or no intervention (Asemi 2013a; Brooke 1980; Delvin 1986; Grant 2013; Mallet 1986; Marya 1988; Roth 2010; Sablok 2015; Yu 2008), while six trials compared provision of oral vitamin D plus calcium supplements versus no intervention or placebo (Asemi 2012, Diogenes 2013; Li 2000a; Marya 1987; Mazurkevich 2013; Taherian 2002).
No studies evaluated the effects of either oral vitamin D plus calcium supplements versus calcium (comparison 3), nor oral vitamin D plus calcium and other micronutrients supplements in comparison with other micronutrients supplements (excluding vitamin D) (comparison 4), nor oral vitamin D + calcium + other vitamins and minerals supplements versus other oral vitamins and minerals supplements (but no vitamin D + calcium) (comparison 5).
Dose and vitamin D form
The dose of vitamin D provided varied in the included trials as well as the regimen.
The daily doses used were 200 IU vitamin D in five trials (Asemi 2012; Diogenes 2013; Li 2000a; Mazurkevich 2013; Taherian 2002); 400 IU vitamin D in two trials (Asemi 2013a; Li 2000a); 800 IU vitamin D in another trial (Yu 2008); 1000 IU vitamin D in four trials (Brooke 1980; Delvin 1986; Grant 2013; Mallet 1986); 1200 IU vitamin D in one trial (Marya 1987); and 2000 IU vitamin D in a one group in Grant 2013.
For single‐dose supplementation of vitamin D, the dose varied from 200,000 IU vitamin D in a group in one study (Yu 2008); 600,000 IU vitamin D in one trial (Marya 1988); and 35,000 IU vitamin D per week (Roth 2010).
For the study by Sablok 2015, the dose depended upon the level of serum 25(OH)‐D levels at baseline; it varied from one dose of 60, 000 IU (if serum 25(OH)‐D levels were > 50 nmol/L), two doses of 120,000 IU (if serum 25(OH)‐D levels were 25–50 nmol/L), or four doses of 120,000 IU (if serum 25(OH)‐D levels < 25 nmol/L).
The vitamin D was provided in the form of cholecalciferol‐D3 in 10 trials (Asemi 2012; Asemi 2013a; Delvin 1986; Diogenes 2013; Grant 2013; Li 2000a; Mazurkevich 2013; Roth 2010; Sablok 2015; Taherian 2002) and as ergocalciferol‐D2 in three trials (Brooke 1980; Mallet 1986; Yu 2008). Two trials do not report the vitamin D form used (Marya 1987; Marya 1988).
Overall, the total provision of supplemental vitamin D provided throughout pregnancy varied. Eight trials provided 56,000 IU vitamin D or less (Asemi 2012; Asemi 2013a; Delvin 1986; Diogenes 2013; Grant 2013; Li 2000a; Mazurkevich 2013; Taherian 2002); five trials provided more than 56,000 to 200,000 IU vitamin D (Brooke 1980; Mallet 1986; Marya 1987; Sablok 2015; Yu 2008), and three trials provided more than 200,000 IU of vitamin D (Marya 1988; Roth 2010; Sablok 2015) throughout pregnancy.
Doses of calcium in the studies providing vitamin D and calcium supplementation
The doses of calcium provided along with the vitamin D ranged from 375 mg of calcium (Marya 1987); 500 mg of calcium as calcium carbonate (Asemi 2012; Taherian 2002); 600 mg calcium (Diogenes 2013; Li 2000a) (as calcium carbonate in Diogenes 2013), and 1250 mg of calcium as calcium carbonate (Mazurkevich 2013).
Health worker cadre
The trials were mostly carried out in the context of antenatal care and the administration of the supplements and the antenatal care was provided by the researchers themselves or through health allied personnel. The outcomes measurements were carried out by different groups according to the nature of the outcome, whether it was clinical, biochemical, anthropometric, or dietary assessments. A more detailed description of the health worker cadre is presented in Characteristics of included studies.
Start of supplementation
The start of the supplementation in the included trials were all in the period of 20 weeks of pregnancy, or more. The supplementation started during the third month of pregnancy (Delvin 1986); at 20 weeks of gestation (Sablok 2015; Taherian 2002); at 20 to 24 weeks of gestation (Li 2000a; Marya 1987); 23 to 29 weeks of gestation (Diogenes 2013); at 25 weeks of pregnancy (Asemi 2012; Asemi 2013a); 26 to 30 weeks of gestation (Grant 2013); 26 to 29 weeks' gestation (Roth 2010); 27 weeks of gestation (Yu 2008); 28 to 32 weeks of gestation (Brooke 1980); second pregnancy trimester until term (Mazurkevich 2013); last trimester of pregnancy (Mallet 1986) and 7th and 8th month of pregnancy (Marya 1988).
Supplementation scheme/regimen
In nine trials there was a group receiving the vitamin D supplements daily (Asemi 2012; Brooke 1980; Delvin 1986; Diogenes 2013; Grant 2013; Li 2000a; Mallet 1986; Marya 1987; Taherian 2002). In three trials the single dose provided was either once weekly or once a month (Marya 1987; Roth 2010; Yu 2008). In the study by Sablok 2015, the supplementation was either once at 20 weeks, twice at 20 and 24 weeks or four times at 20, 24, 28 and 32 weeks of gestation.
Laboratory methodology for the assessment of vitamin D status
Different laboratory methods were used to measure vitamin D status as serum 25‐hydroxyvitamin D [25(OH)D] concentrations. Three trials (Asemi 2012; Asemi 2013a; Sablok 2015) used a commercial ELISA kit (Immuno Diagnostic Systems) for their determinations; one trial used a chemiluminescent enzyme‐labelled immunometric assay (Diogenes 2013); another trial used isotope‐dilution liquid chromatography–tandem mass spectrometry (Grant 2013); or high‐performance liquid chromatography tandem mass spectroscopy (LCMS/MS) (Roth 2010). Two trials used a competitive protein binding assay (Brooke 1980; Mallet 1986), and one trial used a radioligand assay (Delvin 1986). In one trial, the laboratory method was not reported (Yu 2008). Other trials did not report on this outcome (Marya 1987; Marya 1988; Mazurkevich 2013).
SeeCharacteristics of included studies for a detailed description of the studies, including vitamin D doses used and regimens compared.
Excluded studies
We excluded 27 studies. The main reason for exclusion was that the comparisons were among different doses of vitamin D (Bhatia 2012a; Dawodu 2013; Hashemipour 2013; Litonjua 2014; Marya 1981; Mutlu 2013; Roth 2013a; Shakiba 2013; Soheilykhah 2011; Stephensen 2011; Wagner 2010b; Wagner 2010c; Yap 2014), without placebo or no treatment control. In addition, four trials were not randomised trials (Ala‐Houhala 1986; Cockburn 1980; Das 2009; Ito 1994). Three trials (Czech‐Kowalska 2013; Taheri 2014; von Hurst 2009) were conducted on non pregnant women; three other trials were carried out in pregnant women with gestational diabetes (Asemi 2013b; Asemi 2014) or other chronic conditions (Etemadifar 2015). One reference referred to a trial registered in 1986 on the Oxford Database of Perinatal Trials and reports the recruitment and follow‐up completed in 1979, but there were no reports available and we were unable to locate the author who registered the trial (MacDonald 1986). Two trials were excluded for other various reasons (Hossain 2012; Hosseinzadeh 2012). For more detailed descriptions of excluded studies along with the reasons for exclusion, seeCharacteristics of excluded studies.
Risk of bias in included studies
Allocation
Sequence generation
We assessed nine trials as having adequate methods for generating the randomisation sequence. Six of these used computer‐generated random number sequences (Asemi 2013a; Diogenes 2013; Grant 2013; Roth 2010; Sablok 2015; Yu 2008), and the other three trials used a random numbers table (Asemi 2012; Mallet 1986; Taherian 2002) to randomise the intervention groups. The other trials reported the studies as randomised but the methods used to generate the sequence were not described (Brooke 1980; Delvin 1986; Li 2000a; Marya 1987; Marya 1988; Mazurkevich 2013).
Allocation concealment
We judged that five trials had adequate methods of allocation concealment (Asemi 2013a; Asemi 2012; Grant 2013; Roth 2010; Yu 2008). The remaining trials did not report the methods used to conceal the allocation (Brooke 1980; Delvin 1986; Diogenes 2013; Li 2000a; Mallet 1986; Marya 1987; Marya 1988; Mazurkevich 2013; Taherian 2002), if any. Sablok 2015 was as high risk, as participants were assigned to either no intervention or intervention and the intervention dosage depended on the vitamin D status, there was a selection bias based on status of vitamin D at baseline.
Blinding
Blinding of participants, staff and outcome assessors
Investigators in three trials attempted to blind participants and staff by using placebos of similar appearance to active treatment or coded or opaque bottles. Three trials were double blinded (Asemi 2013a; Grant 2013; Roth 2010) and two trials were single blinded (Asemi 2012; Diogenes 2013). In the trial by Asemi 2013a), all tablets were packed identically and coded by the producer to guarantee blinding. In the trial by Grant 2013, treatments were sequentially numbered with an identical numbering code, the bottles were identical in colour, shape, and volume and the tablets were identical in colour, consistency, and taste, such that study staff and participants were unaware of the treatment status. One trial was reported as blinded (Brooke 1980), although it was unclear whether the blinding was specifically for the participants, outcome assessor or care provider. Another trial (Delvin 1986), described that participants were allocated to the intervention by a "blind randomisation process"; however, given that the participants in the control group did not receive an intervention it is unlikely that the trial was blind. Eight trials were not reported as blinded (Delvin 1986; Li 2000a; Mallet 1986; Marya 1987; Mazurkevich 2013; Sablok 2015; Taherian 2002; Yu 2008). While lack of blinding may not represent a serious source of bias for some outcomes (e.g. serum indicators), other outcomes (i.e. reporting of side effects) may have been affected by knowledge of the treatment group.
Incomplete outcome data
With six exceptions Asemi 2012; Asemi 2013a; Grant 2013; Roth 2010; Taherian 2002; Yu 2008), lack of reporting on attrition, missing data and lack of intention‐to‐treat analyses were serious problems in almost all of the included studies. Two trials excluded participants if they had maternal illness (such as diabetes) or pregnancy complications so that they could receive treatment, but these exclusions are not well‐documented (Brooke 1980; Marya 1988). One trial (Marya 1987) only reported biochemical data for those who developed pre‐eclampsia and some of the other participants with no pre‐eclampsia, but not for all the randomised participants. The attrition rate was unclear in one trial (Mallet 1986), and another study had unbalanced losses between the study arms (Delvin 1986). Loss was not balanced across groups in one trial (Sablok 2015).
Selective reporting
We did not have access to study protocols and therefore, formally assessing reporting bias was not possible. One study (Marya 1987) reported data only for some subgroups. Insufficient studies contributed data to allow us to carry out exploration of possible publication bias by using funnel plots.
Other potential sources of bias
Full details of 'Risk of bias' assessments are included in the Characteristics of included studies table. We have also included figures that summarise our 'Risk of bias' assessments (Figure 2; Figure 3).
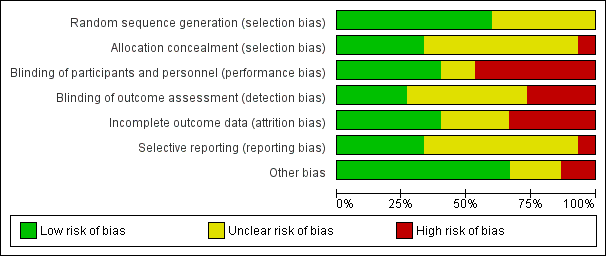
'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.
Effects of interventions
See: Summary of findings for the main comparison Vitamin D alone versus no treatment/placebo (no vitamins or minerals); Summary of findings 2 Vitamin D + calcium versus no treatment/placebo (no vitamin or minerals)
In this updated review we included 15 trials assessing a total of 2833 women. We organised the summary results by comparison and by primary and secondary outcomes.
In the Data and analyses tables, we set up all four prespecified comparisons but outcome data were only available for two of these. We have not added outcomes to those comparisons without data (comparisons three and four). For the comparisons with data, we set up tables for all primary outcomes (even where no data were available) not only to highlight gaps in the current research evidence, but also to be able to add any data that may become available in future updates.
SeeData and analyses for detailed results on primary and secondary outcomes.
For each of the comparisons, we have indicated the number of studies contributing data and the total number of women recruited in these studies. However, for some outcomes only one or two studies provided data and due to loss to follow‐up, denominators for particular outcomes may have been considerably less than the randomised sample. Therefore, we have indicated the number of studies contributing data and the number of women included in that analysis.
(1) Oral vitamin D alone supplements versus no intervention/placebo (no vitamins or minerals) (nine studies, 1251 participants)
Nine studies involving 1251 women were included in this comparison (Asemi 2013a; Brooke 1980; Delvin 1986; Grant 2013; Mallet 1986; Marya 1988; Roth 2010; Sablok 2015; Yu 2008). The following trials were assessed as having low risk of bias: Asemi 2013a; Grant 2013; Roth 2010.
Maternal primary outcomes
Pre‐eclampsia (as defined by trialists)
Data from two trials (Asemi 2013a; Sablok 2015) involving 219 women suggest a trend that women who received vitamin D supplements had a lower risk of pre‐eclampsia than those women receiving no intervention or placebo; but the statistical significance was borderline (8.9% versus 15.5%; average risk ratio (RR) 0.52; 95% confidence interval (CI) 0.25 to 1.05) (Analysis 1.1).
Gestational diabetes (as defined by trialists)
Data from two trials (Asemi 2013a; Sablok 2015) involving 219 women did not find a clear difference in the risk of gestational diabetes between women receiving vitamin D supplementation and women receiving no intervention, or in the placebo group (RR 0.43; 95% CI 0.05 to 3.45) (Analysis 1.2).
Maternal vitamin D concentration at term (25‐hydroxyvitamin D in nmol/L)
The data from seven trials (Asemi 2013a; Brooke 1980; Delvin 1986; Grant 2013; Mallet 1986; Roth 2010; Sablok 2015) involving 868 women consistently show that women who received vitamin D supplements had higher 25‐hydroxyvitamin D concentrations than those women who received no intervention or a placebo. The response to supplementation was highly heterogeneous (Tau² = 554.9, I² = 99% and Chi² test for heterogeneity P < 0.00001) and ranged from 16.3 nmol 25‐hydroxyvitamin D per litre (95% CI 13.6 to 19.0) (Mallet 1986) to 152 nmol 25‐hydroxyvitamin D per litre (95% CI 127 to 177) (Brooke 1980); the large effect reported in this study contributes importantly to the observed heterogeneity. The average mean difference (MD) between groups was 54.73 nmol 25‐hydroxyvitamin D per litre (95% CI 36.60 to 72.86) (Analysis 1.3) but this result should be interpreted cautiously.
The subgroup analysis suggests that women who received vitamin supplementation on a daily basis reached a higher concentration of vitamin D at the end of the pregnancy compared with women who received a single dose, with an average mean difference between groups of 44.12 nmol 25‐hydroxyvitamin D per litre (95% CI 30.24 to 58.00); however, this was highly heterogeneous (Tau² = 417, I² = 99% and Chi² test for heterogeneity P < 0.00001) (Analysis 1.6). With respect to the other subgroup analyses, no conclusions can be reached at this point as some of the subgroups only had one or two trials and the results may be misleading (Analysis 1.4; Analysis 1.5; Analysis 1.8; Analysis 1.9).
Adverse effects (nephritic syndrome)
A single study including 135 women reported on this outcome (Yu 2008). There was no clear evidence difference in the risk of nephritic syndrome between women receiving vitamin D supplementation and women not receiving the intervention or in the placebo group (RR 0.17; 95% CI 0.01 to 4.06) (Analysis 1.15). Given the scarcity of data for this outcome and the wide CIs, no firm conclusions can be drawn.
Infant primary outcomes
Preterm birth (less than 37 weeks' gestation)
Data from three trials (Asemi 2013a; Grant 2013; Sablok 2015) involving 477 women suggest that women who received vitamin D supplements during pregnancy had a lower risk of having a preterm birth than those women receiving no intervention or placebo (3.3% versus 9.9%; average RR 0.36; 95% CI 0.14 to 0.93) (Analysis 1.10).
Low birthweight (less than 2500 g)
The data from three trials (Brooke 1980; Marya 1988; Sablok 2015) involving 493 women suggest that women receiving vitamin D supplements during pregnancy less frequently had a baby with a birthweight below 2500 g than those women receiving no intervention or placebo (9.2% versus 19.6%; average RR 0.40; 95% CI 0.24 to 0.67) (Analysis 1.11).
Maternal secondary outcomes
Caesarean section
Two studies including 312 women reported on this outcome (Roth 2010; Sablok 2015). The data from this trial suggest that the women receiving vitamin D supplementation were as likely to experience a caesarean section than women who did not receive supplementation or placebo (RR 0.95; 95% CI 0.69 to 1.31) (Analysis 1.13) but given the scarcity of data for this outcome, no firm conclusions can be drawn.
No trials reported on our other pre‐specified maternal secondary outcomes: impaired glucose tolerance (as defined by trialists); gestational hypertension (as defined by trialists) or maternal death.
Infant secondary outcomes
Length at birth (cm)
The data from four trials (Brooke 1980; Marya 1988; Roth 2010; Sablok 2015) involving 638 women suggest that there was a trend (P = 0.06) for a higher birth length among infants from women taking vitamin D supplementation during pregnancy compared to women in the no treatment or placebo group (MD 0.70; 95% CI ‐0.02 to 1.43) (Analysis 1.17). There was heterogeneity in the response to the supplementation (Tau² = 0.42; I² = 77% and Chi² test for heterogeneity P = 0.004).
Head circumference at birth (cm)
Four trials involving 638 women (Brooke 1980; Marya 1988; Roth 2010; Sablok 2015) reported on this anthropometric measurement. Results suggest that infants born to women who received vitamin D supplements during pregnancy had a significantly higher mean head circumference at birth than infants born to women who did not receive vitamin D supplements (MD 0.43; 95% CI 0.03 to 0.83) (Analysis 1.18). There was some heterogeneity in the response to the supplementation (Tau² = 0.12; I² = 72% and Chi² test for heterogeneity P = 0.01).
Birthweight (g)
Five trials involving 715 women (Brooke 1980; Mallet 1986; Marya 1988; Roth 2010; Sablok 2015) reported on this outcome. Results suggest that there was no difference of weight at birth in infants from women who received vitamin D supplements in comparison with women who did not receive vitamin D supplements (MD 66.60; 95% CI ‐137.22 to 270.41) (Analysis 1.19). There was some substantial heterogeneity among trials in terms of the size of the treatment (Tau² = 50335; I² = 95% and Chi² test for heterogeneity P < 0.00001). However, when the study by Mallet 1986 is excluded from the analysis, heterogeneity is reduced from 95% to 34% and a significant difference is observed in favour of the vitamin D supplemented group (MD 146.50, 95% CI 67.78 to 225.21, four studies, 638 women). The standard deviations for this study are very small and so we have concerns that these may not be reported correctly.
Stillbirth (as defined by trialists)
Three studies (Grant 2013; Roth 2010; Yu 2008) including 540 women reported this outcome. The data from this trials suggest that the women receiving vitamin D supplementation are as likely to have a stillbirth as women who receive no intervention or placebo (RR 0.35; 95% CI 0.06 to 1.99) (Analysis 1.21).
Neonatal death (within 28 days after delivery)
Two studies (Roth 2010; Yu 2008) including 282 women reported this outcome. There was no clear evidence difference in the risk of neonatal death between women receiving vitamin D supplementation and women not receiving the intervention or in the placebo group (RR 0.27; 95% CI 0.04 to 1.67) (Analysis 1.22), but given the scarcity of data for this outcome no firm conclusions can be drawn.
Apgar score less than seven at five minutes
One study including 165 women did not find clear differences in Apgar scores between groups (RR 0.53, 95% CI 0.11 to 2.53) (Analysis 1.23).
No trials reported on our other pre‐specified infant secondary outcomes: admission to special care (including intensive care) during the neonatal period (within 28 days after delivery); neonatal infection (e.g. respiratory infections) or very preterm birth (less than 34 weeks' gestation).
(2) Oral vitamin D + calcium supplements versus no treatment/placebo (no vitamin or minerals) (six studies, 1688 participants)
Six included trials involving 1688 women made this comparison (Asemi 2012; Diogenes 2013; Li 2000a; Marya 1987; Mazurkevich 2013; Taherian 2002).
Maternal primary outcomes
Pre‐eclampsia (as defined by trialists)
Three trials (Asemi 2012; Marya 1987; Taherian 2002) including 1114 women reported on this outcome. The data from this trial suggest that women receiving vitamin D and calcium supplementation combined are less likely to have pre‐eclampsia as women who receive no intervention or placebo (5% versus 9%; average RR 0.51; 95% CI 0.32 to 0.80) (Analysis 2.1).
Gestational diabetes (as defined by trialists)
A single study including 54 women reported on this outcome (Asemi 2012). There was no clear evidence difference in the risk of gestational diabetes between women receiving vitamin D and calcium supplementation and women not receiving the intervention or in the placebo group (RR 0.33; 95% CI 0.01 to 7.84) (Analysis 2.2), but given the scarcity of data for this outcome and the wide CIs, no firm conclusions can be drawn.
Maternal vitamin D levels at term (25‐hydroxyvitamin D in nmol/L)
No studies reported on this outcome.
Adverse effects
No studies reported on any adverse effects.
Infant primary outcomes
Preterm birth (less than 37 weeks' gestation)
Three studies with 798 participants reported on this outcome (Asemi 2012; Diogenes 2013; Taherian 2002). Women who received vitamin D and calcium supplementation are more likely to deliver prior to 37 weeks of gestation compared to women who received no treatment or placebo (RR 1.57; 95% CI 1.02 to 2.43; low quality) (Analysis 2.4).
Low birthweight (less than 2500 g)
No studies reported on this outcome.
Maternal secondary outcomes
Gestational hypertension
One trial reported on this outcome in 59 participants (Li 2000a). There was no clear difference in the risk of gestational hypertension between women receiving vitamin D and calcium supplement and women not receiving the intervention or on the placebo group (RR 0.26; 95% CI 0.06 to 1.12) (Analysis 2.8).
No trials reported on our pre‐specified maternal secondary outcomes: impaired glucose tolerance (as defined by trialists); caesarean section; side effects (e.g. hypercalcaemia, kidney stones) or maternal death.
Infant secondary outcomes
Neonatal death (within 28 days after delivery)
One trial (Taherian 2002) reported on this outcomes with one death during the study period in the unsupplemented group (RR 0.20; 95% 0.01 to 4.15, one study, 660 participants) (Analysis 2.16).
No trials reported on our pre‐specified infant secondary outcomes: length at birth (cm); head circumference at birth (cm); weight at birth (g); admission to special care (including intensive care) during the neonatal period (within 28 days after delivery); stillbirths (as defined by trialists); Apgar score less than seven at five minutes; neonatal infection (e.g. respiratory infections) or very preterm birth (less than 34 weeks' gestation).
(3) Oral vitamin D + calcium supplements versus calcium supplements (but no vitamin D) (no studies)
No studies were included in this comparison.
(4) Oral vitamin D + calcium + other vitamins and minerals supplements versus calcium + other vitamins and minerals supplements (but no vitamin D) (no studies)
No studies were included in this comparison.
(5) Oral vitamin D + calcium + other vitamins and minerals supplements versus other vitamins and minerals supplements (but no vitamin D + calcium) (no studies)
No studies were included in this comparison.
Subgroup analysis
We attempted to conduct a subgroup analysis but in all the outcomes very few studies contributed data. Indeed, for several subgroups all the trials were in the same subgroup category or only one trial was allocated to one of the subgroup categories impeding any judgements.
As more data become available, in updates of the review, we hope to explore possible subgroup differences by carrying out both visual exploration and formal statistical tests.
Discusión
Resumen de los resultados principales
Esta revisión evalúa los efectos de la administración de suplementos de vitamina D solos o en combinación con calcio y otras vitaminas y minerales durante el embarazo. Incluye 15 ensayos pequeños con 2833 embarazadas, nueve de los cuales compararon vitamina D sola versus ningún tratamiento o placebo y seis ensayos proporcionaron vitamina D más calcio en comparación con ninguna intervención. Ningún estudio evaluó los efectos de la vitamina D más calcio versus calcio o vitamina D más calcio y otros micronutrientes en comparación con otros micronutrientes (pero sin vitamina D).
En comparación con el grupo que recibió ninguna intervención o un placebo:
-
las pacientes embarazadas que recibieron suplementos por vía oral de vitamina D durante el embarazo, en particular diariamente, tuvieron concentraciones significativamente mayores de 25‐hidroxivitamina D al final del embarazo; sin embargo, la respuesta a la administración de suplementos fue muy heterogénea. No hubo diferencias estadísticamente significativas en el riesgo de preeclampsia, pero estos resultados indican un riesgo menor en las mujeres que recibieron suplementos de vitamina D solos (dos ensayos). En las pacientes que recibieron suplementos de vitamina D más calcio (tres ensayos) la reducción del riesgo de preeclampsia alcanzó significación estadística. No se observaron diferencias en los otros resultados maternos.
-
La administración de suplementos de vitamina D durante el embarazo redujo significativamente el riesgo de parto prematuro (tres ensayos) y de bajo peso al nacer (cuatro ensayos). Además, hubo una duración mayor del parto (cuatro ensayos; significación marginal) y un perímetro cefálico mayor en los lactantes de pacientes que recibieron suplementos de vitamina D durante el embarazo. No se observaron diferencias en el peso al nacer entre los grupos que recibieron suplementos y los grupos de ninguna intervención o placebo. Sin embargo, la administración de suplementos de vitamina D y calcio aumentó significativamente el riesgo de parto prematuro (tres ensayos).
-
Con respecto a la seguridad, pocos ensayos informaron los efectos adversos, y solamente un estudio informó un caso único de síndrome nefrítico que ocurrió en una mujer que no recibió administración de suplementos.
Es importante señalar que la mayoría de los ensayos incluidos en esta revisión son de baja calidad metodológica. Además, se detectó heterogeneidad para los resultados de la 25‐hidroxivitamina D y en el perímetro cefálico y la duración del parto. En particular, las inconsistencias en los resultados de los niveles séricos de 25‐hidroxivitamina D podrían estar relacionadas con las diferentes dosis utilizadas en los ensayos incluidos y también con la diferencia en los métodos para evaluar la 25‐hidroxivitamina D sérica. Este biomarcador es difícil y complejo y tiene una variabilidad alta en los resultados entre los métodos utilizados(Holick 2008). La espectrometría de masa con cromatografía líquida de alta resolución es el mejor método disponible(Holick 2005), pero solamente un ensayo utilizó este método. Además, existe una falta de datos sobre la seguridad de la administración de suplementos. Por lo tanto, los resultados deben ser interpretados con cautela.
Compleción y aplicabilidad general de las pruebas
La administración de suplementos de vitamina D durante el embarazo tiene como objetivo mejorar los resultados gestacionales y neonatales. Sin embargo, aunque en esta actualización fue posible más que duplicar los estudios incluidos, hay todavía un número limitado de ensayos que informan todos los resultados de esta revisión. Varios resultados maternos (intolerancia a la glucosa, cesárea, hipertensión gestacional, efectos adversos o muerte) y resultados infantiles (muerte neonatal, ingreso a cuidados especiales [que incluye cuidados intensivos] durante el período neonatal en el transcurso de 28 días después del parto [período neonatal], puntuación de Apgar menor de 7 a los cinco minutos, infección neonatal o nacimiento muy prematuro) no se informaron o se informaron solamente por un ensayo.
La administración de suplementos de vitamina D pareció elevar los niveles séricos de 25‐hidroxivitamina D al final del embarazo. No obstante, la importancia clínica de este resultado y la posibilidad de utilizar esta intervención como parte de la atención prenatal habitual aún están por determinarse.
Para mejorar el conocimiento, actualmente hay 23 estudios en curso que, una vez publicados, aumentarán el grupo de pruebas identificado para la actualización de esta revisión. Después de la publicación y la evaluación general, las conclusiones sobre los efectos y la seguridad de esta intervención se pueden actualizar una vez más. Además, las actualizaciones podrían incluir la respuesta a la dosis de la administración de suplementos de vitamina D sobre resultados importantes del embarazo.
Calidad de la evidencia
El riesgo de sesgo en la mayoría de los ensayos fue incierto y muchos estudios tuvieron alto riesgo de sesgo para el cegamiento y las tasas de desgaste (ver Riesgo de sesgo de los estudios incluidos). Este es en particular el caso de los ensayos más antiguos. En la mayoría de los ensayos más nuevos incluidos se describieron los métodos utilizados para asignar al azar a los participantes, ocultar la asignación y realizar el cegamiento de los participantes, los profesionales sanitarios y los evaluadores de resultado. Sin embargo, el desgaste fue un problema en la mayoría de los estudios.
La calidad del grupo de pruebas para los resultados primarios se evaluó con la metodología GRADE para las dos primeras comparaciones (Resumen de los hallazgos para la comparación principal; Resumen de los hallazgos 2). Se consideró que la falta de direccionalidad o el sesgo de publicación fueron poco probables, pero el riesgo de sesgo de los ensayos, la inconsistencia (o la falta de estudios) y la imprecisión dieron lugar a: pruebas de calidad baja para la preeclampsia, el bajo peso al nacer y los efectos adversos; de calidad muy baja para la diabetes gestacional, las concentraciones de vitamina D materna; y de calidad moderada para los partos prematuros en la comparación de la administración de suplementos de vitamina D solos versus ninguna intervención o placebo. La calidad de las pruebas en los estudios que evaluaron la administración de suplementos de vitamina D más calcio fue baja para la preeclampsia, la diabetes gestacional y los partos prematuros. No se informaron datos sobre los otros resultados primarios (efectos adversos; concentraciones de vitamina D materna; y bajo peso al nacer) para esta comparación.
Sesgos potenciales en el proceso de revisión
Se identificaron varios sesgos potenciales en el proceso de revisión. Se redujeron al mínimo de dos maneras: (1) dos revisores evaluaron de forma independiente la elegibilidad para la inclusión y la extracción de los datos y (2) dos revisores también examinaron de forma independiente la evaluación del riesgo de sesgo y la introducción de los datos. Sin embargo, este tipo de revisión requiere que se emitan varios juicios subjetivos y otros podrían haber tomado decisiones diferentes con respecto a las evaluaciones de la elegibilidad y el riesgo de sesgo. Se invita a los lectores a examinar las características de las tablas de estudios incluidos para ayudar a la interpretación de los resultados.
Acuerdos y desacuerdos con otros estudios o revisiones
Esta revisión actualiza la revisión Cochrane anterior sobre la administración de suplementos de vitamina D en el embarazo (De‐Regil 2012). La revisión anterior incluyó seis ensayos con un total de 1023 mujeres y excluyó ocho estudios, y 10 estudios estaban todavía en curso. Evaluó los mismos resultados maternos e infantiles; sin embargo, solamente unos pocos de estos resultados estaban incluidos en esos ensayos, por lo que concluyó que la administración de suplementos de vitamina D en una dosis única o continua durante el embarazo aumentó la 25‐hidroxivitamina D sérica al término, pero la significación clínica de este resultado y la seguridad de este tipo de administración de suplementos aún no se ha determinado debido al escaso número de ensayos de alta calidad y los resultados informados. Para esta actualización más estudios informaron los resultados de interés y se concluyó que hay alguna indicación que la administración de suplementos de vitamina D puede reducir el riesgo de preeclampsia, parto prematuro y bajo peso al nacer. Sin embargo, todavía no hay suficientes datos para confirmar los efectos sobre estos resultados de salud maternos e infantiles ni para determinar los efectos sobre los otros resultados estudiados, ya que no se informaron o se evaluaron solamente en un ensayo.
Una revisión sistemática reciente de estudios de intervención con vitamina D durante el embarazo encontró algunos resultados similares (Harvey 2014). De los siete ensayos que evaluaron los efectos de la administración de suplementos de vitamina D sobre el peso al nacer, tres estudios demostraron un peso al nacer significativamente mayor en los lactantes de madres que recibieron suplementos, mientras que los otros cuatro no encontraron un efecto significativo. Para la duración del parto se identificaron dos ensayos; uno encontró que la administración de suplementos de vitamina D provocó una mayor duración del parto de los lactantes de las pacientes que recibieron administración de suplementos, mientras el otro ensayo encontró que "no hubo una asociación significativa, pero hubo una tendencia hacia una duración mayor del parto en el grupo que recibió suplementos" en comparación con el grupo control. Además, en los dos ensayos que evaluaron el perímetro cefálico de la descendencia, uno encontró un perímetro cefálico significativamente mayor, mientras que el otro encontró una tendencia no significativa hacia un mayor perímetro cefálico en las madres que recibieron suplementos. Solamente se identificó una intervención para la preeclampsia (ninguna diferencia en el riesgo entre los grupos) y no se identificaron intervenciones para el parto prematuro, el bajo peso al nacer, la diabetes gestacional y la cesárea.
Otra revisión sistemática y metanálisis recientes de 13 ensayos (n = 2299) que administraron suplementos de vitamina D a las embarazadas evaluaron resultados similares a los de la presente revisión (Perez‐Lopez 2015). Esta revisión incluyó vitamina D sola versus ningún tratamiento o placebo; vitamina D más calcio versus ningún tratamiento o placebo; y vitamina D más calcio versus calcio (el grupo placebo incluyó un bajo nivel de vitamina D, 400 UI/d). La 25‐hidroxivitamina D sérica al término fue significativamente mayor en el grupo que recibió suplementos en comparación con el grupo control (diferencia de medias 66,5 nmol/l; intervalo de confianza (IC) del 95%: 66,2 a 66,7; 10 ensayos; 1468 mujeres), similar a la presente revisión. Sin embargo, al contrario con la presente revisión, Perez‐Lopez 2015 encontró que la administración de suplementos de vitamina D no influyó en la incidencia de preeclampsia (tres estudios; 654 participantes), el bajo peso al nacer (cuatro estudios; 496 participantes) y el parto prematuro (tres estudios; 384 participantes), a la vez que aumentó significativamente el peso al nacer (10 estudios; 1489 participantes) y la duración del parto (seis estudios; 866 participantes). De forma consistente con la presente revisión, la administración de suplementos de vitamina D no influyó en la incidencia de diabetes mellitus gestacional (tres estudios; 384 participantes), ni en la cesárea (cuatro estudios; 1028 participantes). Estas diferencias en los resultados entre los metanálisis se pueden deber a la inclusión de grupos control con niveles bajos de vitamina D (400 UI/d) en el último metanálisis.
Otra revisión evaluó el efecto de la administración de suplementos de vitamina D versus placebo, que incluyó dosis de vitamina D bajas (400 UI/d) o ninguna intervención durante el embarazo para la reducción del riesgo de preeclampsia (Hyppönen 2013). En los cuatro ensayos identificados que incluyeron 5871 mujeres, la administración de suplementos de vitamina D redujo significativamente el riesgo de preeclampsia en comparación con el grupo control (odds ratio 0,66; IC del 95%: 0,52 a 0,83). En la presente revisión se encontró una tendencia a la reducción del riesgo de preeclampsia en las pacientes que recibieron suplementos de vitamina D durante el embarazo en comparación con ninguna administración de suplementos.
En concordancia con los resultados de la presente revisión, una revisión (Thorne‐Lyman 2012) también encontró un riesgo menor del 60% de bajo peso al nacer en las pacientes que recibieron suplementos de vitamina D durante el embarazo (tres ensayos; 507 participantes). Sin embargo, no se observó una tendencia en la reducción del parto prematuro en los dos ensayos incluidos (529 participantes) con la administración de suplementos de vitamina D. Esta revisión incluyó estudios con dosis baja de vitamina D (400 UI/d) en el grupo placebo o control.
En general, las revisiones sistemáticas y metanálisis disponibles han mostrado de forma consistente que los niveles séricos de 25‐hidroxivitamina D son significativamente mejores con la administración de suplementos de vitamina D. Sin embargo, hay diferencias importantes en los resultados. Aunque esta revisión y otra (Hyppönen 2013) mostraron una tendencia o una reducción significativa en el riesgo de preeclampsia con la administración de suplementos de vitamina D, una revisión (Perez‐Lopez 2015) no la encontró. Además, se encontraron diferencias en la reducción del parto prematuro y el bajo peso al nacer. Cuando se publiquen más estudios será posible dilucidar estos resultados contradictorios.
También se examinaron los resultados de los ensayos excluidos que analizaron diferentes dosis de vitamina D sin un grupo placebo (el placebo incluyó una dosis inferior de suplementos de vitamina D) (ver Tabla 1). Fue evidente a partir de la mayoría de los ensayos que la dosis mayor de vitamina D empleada dio lugar a una 25‐hidroxivitamina D sérica significativamente mayor al término o al final del período de administración de los suplementos en comparación con la dosis inferior (generalmente 400 UI/d). Los dos estudios que evaluaron el peso al nacer encontraron que fue mayor entre los lactantes de madres que recibieron suplementos de vitamina D a dosis de 60 000 o 120 000 UI (dosis total administrada una o dos veces) en comparación con las pacientes del grupo atención habitual (Bhatia 2012a) y las madres que recibieron dosis de 2000 UI/d (Stephensen 2011) en comparación con el grupo control (400 UI/d). De manera similar, la duración del parto y el perímetro cefálico fueron mayores en las madres que recibieron suplementos con dosis de 60 000 o 120 000 UI en comparación con las pacientes en el grupo atención habitual (Bhatia 2012a) o que recibieron dosis de 50 000 UI por semana (+ calcio) en comparación con el grupo control (400 UI/d) (Hashemipour 2013). Además, la administración de suplementos a dosis de 50 000 UI cada dos semanas mejoró significativamente la resistencia a la insulina en un ensayo (Soheilykhah 2011) pero la administración de suplementos a dosis de 5000 UI/d no mejoró los niveles de glucosa en otro estudio (Yap 2014).
Con respecto a la seguridad, los ensayos que informaron resultados maternos e infantiles relacionados con la seguridad indican que la administración de suplementos de vitamina D parece ser segura durante el embarazo. Sin embargo, ningún ensayo informó la mayoría de los resultados definidos en esta revisión (muerte materna, ingreso del neonato a una unidad de cuidados intensivos, puntuación de Apgar menor de 7 a los cinco minutos, infección neonatal o parto muy prematuro). El ensayo Sablok 2015 informó la puntuación de Apgar menor de 3 o 7, sin diferencias entre los grupos con suplementos o placebo. Se necesitan más ensayos para informar sobre estos resultados relacionados con la seguridad para establecer una conclusión definitiva.

Study flow diagram for this update

'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.

Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 1 Pre‐eclampsia (ALL).

Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 2 Gestational diabetes (ALL).

Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 3 Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (ALL).
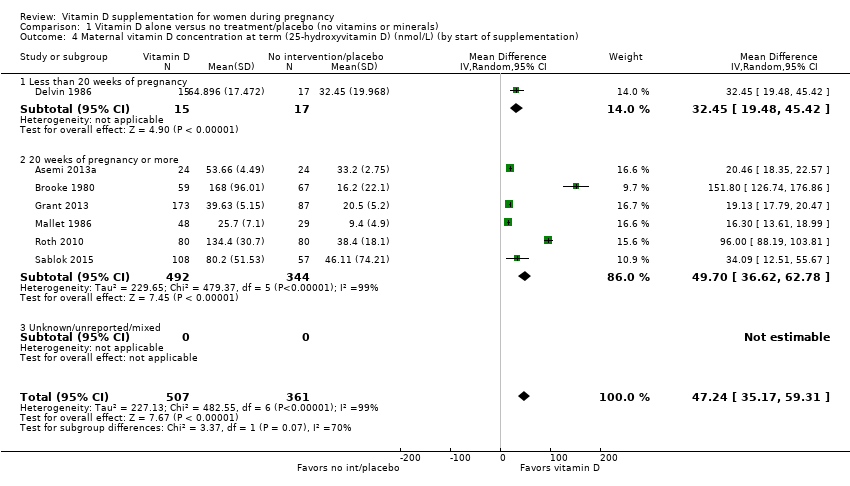
Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 4 Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (by start of supplementation).

Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 5 Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (by pre‐gestational body mass index (kg/m2)).

Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 6 Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (by supplementation scheme/regimen).
Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 7 Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (by skin pigmentation based on Fitzpatrick skin tone chart).

Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 8 Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (by latitude).

Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 9 Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (by season at the start of pregnancy).

Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 10 Preterm birth (less than 37 weeks' gestation) (ALL).

Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 11 Low birthweight (less than 2500 g) (ALL).

Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 13 Caesarean section.
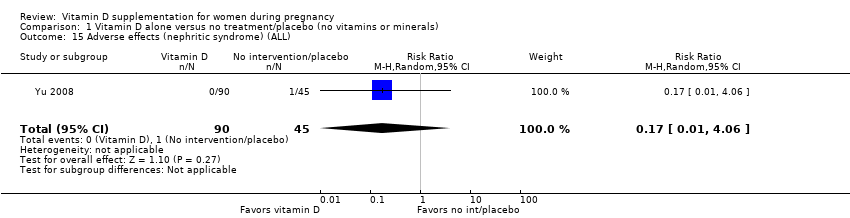
Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 15 Adverse effects (nephritic syndrome) (ALL).

Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 16 Maternal death (death while pregnant or within 42 days of termination of pregnancy) (ALL).

Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 17 Birth length (cm) (ALL).
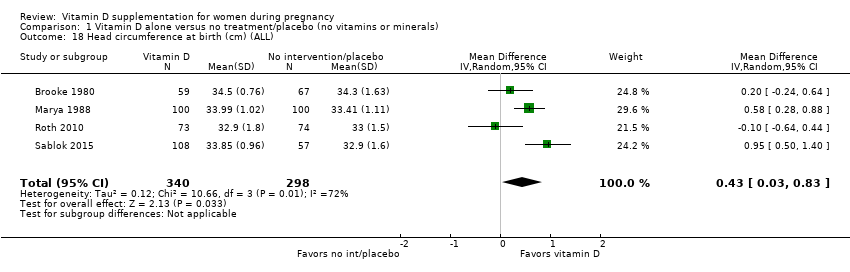
Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 18 Head circumference at birth (cm) (ALL).

Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 19 Birthweight (g) (ALL).

Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 21 Stillbirth (ALL).

Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 22 Neonatal death (ALL).

Comparison 1 Vitamin D alone versus no treatment/placebo (no vitamins or minerals), Outcome 23 Apgar score less than seven at five minutes.
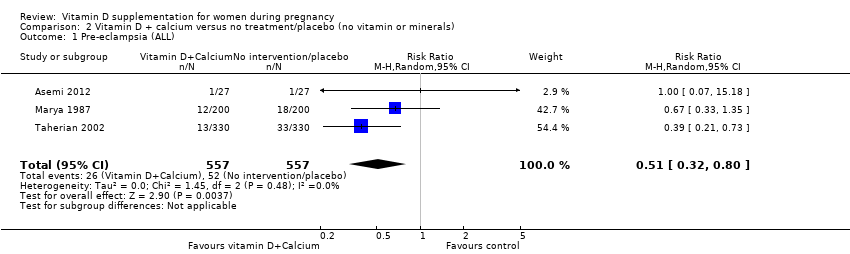
Comparison 2 Vitamin D + calcium versus no treatment/placebo (no vitamin or minerals), Outcome 1 Pre‐eclampsia (ALL).

Comparison 2 Vitamin D + calcium versus no treatment/placebo (no vitamin or minerals), Outcome 2 Gestational diabetes (ALL).

Comparison 2 Vitamin D + calcium versus no treatment/placebo (no vitamin or minerals), Outcome 4 Preterm birth (less than 37 weeks' gestation) (ALL).

Comparison 2 Vitamin D + calcium versus no treatment/placebo (no vitamin or minerals), Outcome 8 Gestational hypertension.
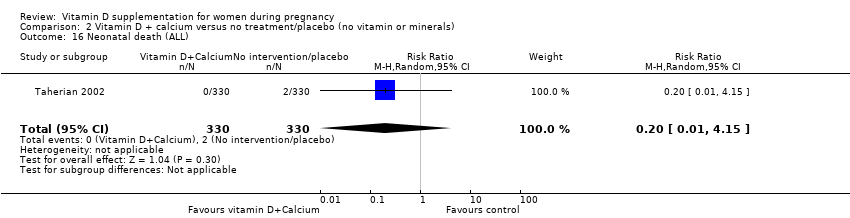
Comparison 2 Vitamin D + calcium versus no treatment/placebo (no vitamin or minerals), Outcome 16 Neonatal death (ALL).
| Population: women during pregnancy | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk with no treatment/placebo (no vitamins or minerals) | Risk with vitamin D alone | |||||
| Pre‐eclampsia (ALL) | Study population | RR 0.52 | 219 | ⊕⊕⊝⊝ | ||
| 155 per 1000 | 80 per 1000 | |||||
| Moderate | ||||||
| 124 per 1000 | 64 per 1000 | |||||
| Gestational diabetes (ALL) | Study population | RR 0.43 | 219 | ⊕⊝⊝⊝ | ||
| 24 per 1000 | 10 per 1000 | |||||
| Moderate | ||||||
| 27 per 1000 | 12 per 1000 | |||||
| Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (ALL) | The mean maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (ALL) in the intervention group was 47.24 higher (35.17 to 59.31 higher) | 868 | ⊕⊕⊝⊝ | |||
| Adverse effects | Study population | RR 0.17 (0.01 to 4.06) | 135 (1 RCT) | ⊕⊕⊝⊝ | ||
| 22 per 1000 | 4 per 1000 (0 to 90) | |||||
| Preterm birth (less than 37 weeks' gestation) (ALL) | Study population | RR 0.36 | 477 | ⊕⊕⊕⊝ | ||
| 99 per 1000 | 36 per 1000 | |||||
| Moderate | ||||||
| 46 per 1000 | 17 per 1000 | |||||
| Low birthweight (less than 2500 g) (ALL) | Study population | RR 0.40 | 493 | ⊕⊕⊕⊝ | ||
| 199 per 1000 | 80 per 1000 | |||||
| Moderate | ||||||
| 193 per 1000 | 77 per 1000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Most studies contributing data had design limitations (high risk for allocation concealment and attrition bias). 2 Wide confidence interval crossing the line of no effect. 3 Wide confidence interval crossing the line of no effect & few events. 4 Statistical heterogeneity (I² > 60%). Considerable variation in size of effect. | ||||||
| Population: women during pregnancy | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk with no treatment/placebo (no vitamin or minerals) | Risk with vitamin D + calcium | |||||
| Pre‐eclampsia (ALL) | Study population | RR 0.51 | 1114 | ⊕⊕⊕⊝ | ||
| 93 per 1000 | 48 per 1000 | |||||
| Moderate | ||||||
| 90 per 1000 | 46 per 1000 | |||||
| Gestational diabetes (ALL) | Study population | RR 0.33 | 54 | ⊕⊕⊝⊝ | ||
| 37 per 1000 | 12 per 1000 | |||||
| Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (ALL) | (0 studies) | No trial assessed this outcome. | ||||
| Adverse effects | (0 studies) | No trial assessed this outcome. | ||||
| Preterm birth (less than 37 weeks' gestation) (ALL) | Study population | RR 1.57 | 798 | ⊕⊕⊕⊝ | **Because there were zero events in some of the groups in two out of three of the included trials, GRADEpro GDT did not produce corresponding risks for a moderate risk population. | |
| 73 per 1000 | 114 per 1000 | |||||
| Moderate | ||||||
| ** | ** | |||||
| Low birthweight (less than 2500 g) (ALL) | Study population | Not estimable | (0 studies) | No trial assessed this outcome. | ||
| Not pooled | Not pooled | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Most studies contributing data had design limitations (selection bias was unclear and high risk of attrition bias) 2 Wide confidence interval crossing the line of no effect, few events & small sample size. | ||||||
| Author | Location and setting | Participants (age, number, gestational week) | Randomisation process | Vitamin D supplement dose(s) | Type of vitamin D supplement | Results |
| India (antenatal clinics) | 299 pregnant women; 12‐24 weeks of gestation (lower middle and middle socio‐economic) | Random number tables | 60,000 IU; 120,000 IU; Usual care | Cholecalciferol | 25OHD at term was higher in those on the higher dose compared to the lower dose. Birthweight, length and HC were greater in the supplemented groups versus usual care. | |
| United Arab Emirates (primary and tertiary perinatal care centres) | 192 pregnant women; 12‐16 weeks of gestation | Stratified block design (seasonally balanced) using computer‐generated lists | 400 IU/d; 2,000 IU/d; 4000 IU/d | Cholecalciferol | 25OHD at term was higher with 4000 IU/d versus 2000 IUd versus 400 IU/d (P < 0.001). | |
| Iran (obstetric clinic) | 160 pregnant women; 24–26 weeks of gestation; singleton pregnancy and BMI:19–26 kg/m2 | Computer‐generated random numbers (open‐label randomised) | 400 IU/d (+200 mg calcium; 50,000 IU/week (+ calcium) | Cholecalciferol | Length, HC and weight were significantly higher in the intervention group compared with the control group. | |
| US (prenatal clinical centres in Boston, Saint Louis, San Diego) | 881 pregnant women, history of asthma/allergies; aged 18‐40 years; 10‐18 weeks' gestation | Stratified permuted blocks with randomly varied block sizes of 4 and 6, and 1 block allocation list per stratum | 400 IU/d; 4400 IU/d | Cholecalciferol | Not published yet. | |
| India | 45 Hindu pregnant women | Not reported | No vitamin D; 1200 IU/d (+375 mg calcium); 600,000 IU (at 7th and 8th month). | Ergocalciferol | Supplementation with 1200 U/d led to significantly higher birthweight and this was even higher in those taking the 2 doses of 600,000. | |
| Turkey (Hospital) | 91 pregnant women; aged 16‐42 years; singleton | Reported: simple randomisation method | 600 IU/d; 1,200 IU/d; 2,000 IU/d | Cholecalciferol | 25OHD was significantly higher in the 2,000 IU/d group versus the other groups | |
| Bangladesh (maternal health clinic) | 28 pregnant women; aged 18‐34 years; 27 to 30 weeks | Not specified | 70,000 IU (single dose on day 0) + 35,000 IU/week (from day 7); 14,000 IU/week (from day 0; control group) | Cholecalciferol | A dose‐response effect was observed in 25OHD with the higher dose versus control | |
| Iran (2 primary care clinics) | 51 healthy pregnant women; second trimester of pregnancy; autumn and winter | Not specified | 50,000 IU/month; 100,000 IU/month | Cholecalciferol | 76% of neonates in group with 50,000 IU/d month and 100% of neonates in group with 100,000 IU/month had 25OHD > 20 ng/mL. | |
| Iran (2 prenatal clinics) | 120 healthy non‐obese pregnant women; < 12th week of pregnancy | Not specified | 200 IU/d; 50,000 IU/month; 50,000 IU every 2 weeks | Cholecalciferol | 25OHD was higher in those on the higher dose versus middle versus lower doses. Supplementation with 50,000 IU every 2 weeks significantly improved insulin resistance | |
| USA (Research Center and university care centres) | 57 healthy pregnant women; <20 weeks' gestation;>18 years | Not specified | 400 IU/d; 2,000 IU/d | Cholecalciferol | Greater increase in 25OHD and higher infant birthweight among those on the 2000 IU/d group. | |
| USA (University prenatal care) | 494 healthy pregnant women; aged 16‐45 years; 12‐16 weeks of gestation; singleton | Stratified blocked randomisation to balance by ethnicity. | 400 IU/d; 2000 IU/d; 4000 IU/d. All women received daily multiple micronutrients supplements | Cholecalciferol | Greater increase in 25OHD among those on the 2000 IU/d and 4000 IU/d groups. | |
| USA (University prenatal care) | 257 healthy pregnant women; aged 16‐45 years; 12‐16 weeks of gestation; singleton | Randomisation stratified based on initial 25OHD, using lists generated by computer prior to the start of the study. | 2000 IU/d; 4000 IU/d. All women received daily multiple micronutrients supplements | Cholecalciferol | 25OHD significantly increase in both groups from baseline. Preterm birth was inversely associated with 25OHD at delivery | |
| Australia | 179 pregnant women; 18 years of age or older; singleton pregnancy; with low baseline 25OHD; < 20 weeks of gestation | Randomisation was in a 1:1 ratio, with a permuted block size of 6 and sequential assignment. | 400 IU/d; 5000 IU/d | Cholecalciferol | No difference in maternal OGTT between groups. | |
| Abbreviations used 25OHD: 25‐hydroxycholecalciferol | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Pre‐eclampsia (ALL) Show forest plot | 2 | 219 | Risk Ratio (M‐H, Random, 95% CI) | 0.52 [0.25, 1.05] |
| 2 Gestational diabetes (ALL) Show forest plot | 2 | 219 | Risk Ratio (M‐H, Random, 95% CI) | 0.43 [0.05, 3.45] |
| 3 Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (ALL) Show forest plot | 7 | 868 | Mean Difference (IV, Random, 95% CI) | 54.73 [36.60, 72.86] |
| 4 Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (by start of supplementation) Show forest plot | 7 | 868 | Mean Difference (IV, Random, 95% CI) | 47.24 [35.17, 59.31] |
| 4.1 Less than 20 weeks of pregnancy | 1 | 32 | Mean Difference (IV, Random, 95% CI) | 32.45 [19.48, 45.42] |
| 4.2 20 weeks of pregnancy or more | 6 | 836 | Mean Difference (IV, Random, 95% CI) | 49.70 [36.62, 62.78] |
| 4.3 Unknown/unreported/mixed | 0 | 0 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 5 Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (by pre‐gestational body mass index (kg/m2)) Show forest plot | 7 | 868 | Mean Difference (IV, Random, 95% CI) | 47.24 [35.17, 59.31] |
| 5.1 Underweight (lower than 18.5) | 0 | 0 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 5.2 Normal weight (18.5 to 24.9) | 1 | 165 | Mean Difference (IV, Random, 95% CI) | 34.09 [12.51, 55.67] |
| 5.3 Overweight (25 or higher) | 2 | 308 | Mean Difference (IV, Random, 95% CI) | 19.54 [18.34, 20.74] |
| 5.4 Unknown/unreported/mixed | 4 | 395 | Mean Difference (IV, Random, 95% CI) | 73.18 [21.00, 125.36] |
| 6 Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (by supplementation scheme/regimen) Show forest plot | 8 | 1043 | Mean Difference (IV, Random, 95% CI) | 44.12 [30.24, 58.00] |
| 6.1 Single dose | 3 | 340 | Mean Difference (IV, Random, 95% CI) | 15.16 [5.68, 24.63] |
| 6.2 Daily | 6 | 703 | Mean Difference (IV, Random, 95% CI) | 57.80 [38.37, 77.23] |
| 6.3 Weekly | 0 | 0 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 7 Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (by skin pigmentation based on Fitzpatrick skin tone chart) Show forest plot | 7 | 868 | Mean Difference (IV, Random, 95% CI) | 47.24 [35.17, 59.31] |
| 7.1 Three or less | 0 | 0 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 7.2 Four or more | 0 | 0 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 7.3 Unknown/unreported/mixed | 7 | 868 | Mean Difference (IV, Random, 95% CI) | 47.24 [35.17, 59.31] |
| 8 Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (by latitude) Show forest plot | 7 | 868 | Mean Difference (IV, Random, 95% CI) | 47.24 [35.17, 59.31] |
| 8.1 Between Tropics of Cancer and Capricorn | 1 | 260 | Mean Difference (IV, Random, 95% CI) | 19.13 [17.79, 20.47] |
| 8.2 North of the Tropic of Cancer or South of the Tropic of Capricorn | 6 | 608 | Mean Difference (IV, Random, 95% CI) | 55.73 [35.67, 75.80] |
| 8.3 Unknown/unreported | 0 | 0 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 9 Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (by season at the start of pregnancy) Show forest plot | 7 | 868 | Mean Difference (IV, Random, 95% CI) | 47.24 [35.17, 59.31] |
| 9.1 Summer | 1 | 160 | Mean Difference (IV, Random, 95% CI) | 96.0 [88.19, 103.81] |
| 9.2 Winter | 1 | 77 | Mean Difference (IV, Random, 95% CI) | 16.30 [13.61, 18.99] |
| 9.3 Mixed seasons | 5 | 631 | Mean Difference (IV, Random, 95% CI) | 37.24 [27.46, 47.02] |
| 10 Preterm birth (less than 37 weeks' gestation) (ALL) Show forest plot | 3 | 477 | Risk Ratio (M‐H, Random, 95% CI) | 0.36 [0.14, 0.93] |
| 11 Low birthweight (less than 2500 g) (ALL) Show forest plot | 3 | 493 | Risk Ratio (M‐H, Random, 95% CI) | 0.40 [0.24, 0.67] |
| 12 Impaired glucose tolerance | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 13 Caesarean section Show forest plot | 2 | 312 | Risk Ratio (M‐H, Random, 95% CI) | 0.95 [0.69, 1.31] |
| 14 Gestational hypertension | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 15 Adverse effects (nephritic syndrome) (ALL) Show forest plot | 1 | 135 | Risk Ratio (M‐H, Random, 95% CI) | 0.17 [0.01, 4.06] |
| 16 Maternal death (death while pregnant or within 42 days of termination of pregnancy) (ALL) Show forest plot | 1 | 180 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 17 Birth length (cm) (ALL) Show forest plot | 4 | 638 | Mean Difference (IV, Random, 95% CI) | 0.70 [‐0.02, 1.43] |
| 18 Head circumference at birth (cm) (ALL) Show forest plot | 4 | 638 | Mean Difference (IV, Random, 95% CI) | 0.43 [0.03, 0.83] |
| 19 Birthweight (g) (ALL) Show forest plot | 5 | 715 | Mean Difference (IV, Random, 95% CI) | 66.60 [‐137.22, 270.41] |
| 20 Admission to special care (including intensive care) during the neonatal period (within 28 days after delivery) (ALL) | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 21 Stillbirth (ALL) Show forest plot | 3 | 540 | Risk Ratio (M‐H, Random, 95% CI) | 0.35 [0.06, 1.99] |
| 22 Neonatal death (ALL) Show forest plot | 2 | 282 | Risk Ratio (M‐H, Random, 95% CI) | 0.27 [0.04, 1.67] |
| 23 Apgar score less than seven at five minutes Show forest plot | 1 | 165 | Risk Ratio (M‐H, Random, 95% CI) | 0.53 [0.11, 2.53] |
| 24 Neonatal infection | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 25 Very preterm birth | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Pre‐eclampsia (ALL) Show forest plot | 3 | 1114 | Risk Ratio (M‐H, Random, 95% CI) | 0.51 [0.32, 0.80] |
| 2 Gestational diabetes (ALL) Show forest plot | 1 | 54 | Risk Ratio (M‐H, Random, 95% CI) | 0.33 [0.01, 7.84] |
| 3 Maternal vitamin D concentration at term (25‐hydroxyvitamin D) (nmol/L) (ALL) | 0 | 0 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 4 Preterm birth (less than 37 weeks' gestation) (ALL) Show forest plot | 3 | 798 | Risk Ratio (M‐H, Random, 95% CI) | 1.57 [1.02, 2.43] |
| 5 Low birthweight (less than 2500 g) (ALL) | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 6 Impaired glucose tolerance | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 7 Caesarean section | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 8 Gestational hypertension Show forest plot | 1 | 59 | Risk Ratio (M‐H, Random, 95% CI) | 0.26 [0.06, 1.12] |
| 9 Adverse effects (ALL) | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 10 Maternal death (death while pregnant or within 42 days of termination of pregnancy) | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 11 Birth length (cm) (ALL) | 0 | 0 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 12 Head circumference at birth (cm) (ALL) | 0 | 0 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 13 Birthweight (g) (ALL) | 0 | 0 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 14 Admission to special care (including intensive care) during the neonatal period (within 28 days after delivery) (ALL) | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 15 Stillbirth (ALL) | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 16 Neonatal death (ALL) Show forest plot | 1 | 660 | Risk Ratio (M‐H, Random, 95% CI) | 0.2 [0.01, 4.15] |
| 17 Apgar score less than seven at five minutes | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 18 Neonatal infection | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 19 Very preterm birth | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |

