Alfabloqueadores como tratamiento expulsivo médico para los cálculos ureterales
Resumen
Antecedentes
El cólico ureteral es un motivo frecuente por el que los pacientes solicitan atención médica. Los alfabloqueadores se utilizan habitualmente para mejorar la expulsión de los cálculos mediante el denominado tratamiento expulsivo médico (TEM), pero su efectividad aún es polémica. Ésta es una actualización de una revisión Cochrane de 2014; desde entonces se han informado varios ensayos controlados aleatorios (ECA) grandes, lo que hace que esta actualización sea relevante.
Objetivos
Evaluar los efectos de los alfabloqueadores comparados con tratamiento estándar para los cálculos ureterales de 1 cm o menos confirmados mediante imagenología en pacientes adultos que presentan síntomas de la enfermedad por cálculo ureteral.
Métodos de búsqueda
El 18 noviembre 2017, se hicieron búsquedas en CENTRAL, MEDLINE Ovid y Embase. También se hicieron búsquedas en ClinicalTrials.gov y en WHO Portal/ICTRP para identificar todos los ensayos publicados/no publicados y en curso. Se verificaron todas las referencias de los artículos incluidos y de revisión y las actas de congresos para los artículos relevantes para esta revisión. Se enviaron cartas a los investigadores para solicitar información sobre estudios no publicados o incompletos.
Criterios de selección
Se incluyeron los ECA de expulsión de los cálculos ureterales en pacientes adultos que compararon alfabloqueadores versus tratamiento estándar.
Obtención y análisis de los datos
Dos autores de la revisión examinaron los estudios para su inclusión y extrajeron los datos mediante procedimientos metodológicos estándar. El metanálisis se realizó mediante el modelo de efectos aleatorios. Los resultados primarios fueron expulsión del cálculo y eventos adversos graves; los resultados secundarios fueron tiempo transcurrido hasta la expulsión del cálculo, número de episodios de dolor, administración de diclofenaco, hospitalización e intervención quirúrgica. La calidad de la evidencia por resultado se evaluó mediante el enfoque GRADE.
Resultados principales
Se incluyeron 67 estudios con 10 509 participantes en total. De estos estudios, 15 con 5787 participantes utilizaron placebo.
Expulsión del cálculo: Según el análisis general, el tratamiento con un alfabloqueador puede dar lugar a un aumento grande en la expulsión del cálculo (cociente de riesgos [CR] 1,45; intervalo de confianza [IC] del 95%: 1,36 a 1,55; evidencia de baja calidad). Un subgrupo de ensayos controlados con placebo de calidad más alta indica que es posible que el efecto probable sea más pequeño (CR 1,16; IC del 95%: 1,07 a 1,25; evidencia de calidad moderada), lo que corresponde a 116 más (IC del 95%: 51 más a 182 más) expulsiones del cálculo por 1000 participantes.
Eventos adversos graves: Según el análisis general, el tratamiento con un alfabloqueador puede tener poco efecto sobre los eventos adversos graves (CR 1,25; IC del 95%: 0,80 a 1,96; evidencia de baja calidad). Un subgrupo de ensayos controlados con placebo de calidad más alta indica que es probable que los alfabloqueadores aumenten ligeramente el riesgo de eventos adversos graves (CR 2,09; IC del 95%: 1,13 a 3,86), lo que corresponde a 29 eventos adversos graves más (IC del 95%: 3 más a 75 más) por 1000 participantes.
Los pacientes tratados con alfabloqueadores pueden presentar tiempos transcurridos hasta la expulsión del cálculo más cortos (diferencia de medias [DM] ‐3,40 días, IC del 95%: ‐4,17 a ‐2,63; evidencia de baja calidad), pueden utilizar menos diclofenaco (DM ‐82,41; IC del 95%: ‐122,51 a ‐42,31; evidencia de baja calidad), y es probable que requieran menos hospitalizaciones (CR 0,51; IC del 95%: 0,34 a 0,77; evidencia de calidad moderada), lo que corresponde a 69 hospitalizaciones menos (IC del 95%: 93 menos a 32 menos) por 1000 participantes. Entretanto, la necesidad de intervención quirúrgica parece ser similar (CR 0,74; IC del 95%: 0,53 a 1,02; evidencia de baja calidad), lo que corresponde a 28 intervenciones quirúrgicas menos (IC del 95%: 51 menos a 2 más) por 1000 participantes.
Un análisis de subgrupos predefinido (prueba de diferencias de subgrupos; p = 0,002) indica que los efectos de los alfabloqueadores pueden variar con el tamaño del cálculo, CR 1,06 (IC del 95%: 0,98 a 1,15; P = 0,16; I² = 62%) para los cálculos de 5 mm o menos versus 1,45 (IC del 95%: 1,22 a 1,72; P < 0,0001; I² = 59%) para los cálculos mayores de 5 mm. No se encontró evidencia que indique posibles efectos de subgrupos según la ubicación del cálculo o el tipo de alfabloqueador.
Conclusiones de los autores
En los pacientes con cálculos ureterales, es probable que los alfabloqueadores aumenten la expulsión del cálculo, pero también es probable que aumenten el riesgo de eventos adversos graves. Los análisis de subgrupos indican que los alfabloqueadores pueden ser menos efectivos para los cálculos más pequeños (5 mm o menos) que para los cálculos más grandes (mayores de 5 mm).
PICOs
Resumen en términos sencillos
Alfabloqueadores para los cálculos ureterales en pacientes adultos con síntomas de enfermedad por cálculos
Pregunta de la revisión
¿El tratamiento médico con alfabloqueadores mejora los resultados de los pacientes con cálculos atascados en el uréter?
Antecedentes
Los cálculos atascados en el uréter, que es el conducto que transporta la orina del riñón a la vejiga, a menudo causan dolor y hacen que los pacientes consulten a un médico. Según en qué parte del uréter se atasca el cálculo y el tamaño del cálculo, a menudo pasará a la vejiga por sí solo en el transcurso de semanas. Si el cálculo no sale solo, los pacientes a menudo necesitan que se les realicen procedimientos para expulsar el cálculo.
Los alfabloqueadores son fármacos que relajan los músculos en las vías urinarias y pueden hacer que el cálculo pase más rápido hacia la vejiga. Sin embargo, pueden causar efectos no deseados. Se actualizó una revisión Cochrane existente desde 2014 para investigar los efectos de los alfabloqueadores.
Características de los estudios
En base a la última búsqueda de la literatura a partir de noviembre de 2017, se incluyeron 64 estudios con 10 509 participantes. De estos estudios, 15 compararon alfabloqueadores con placebo en 5787 participantes. Un placebo es una pastilla que se ve y sabe exactamente como la medicación real, de manera que los participantes no sabían lo que recibían. Estos estudios tuvieron la calidad más alta, y en los que hay más confianza.
Resultados clave
Según el subgrupo de estudios de calidad más alta que utilizaron placebo, es probable que los alfabloqueadores den lugar a que más pacientes expulsen sus cálculos. Sin embargo, es probable que estos pacientes presenten ligeramente más efectos graves no deseados de esta medicación.
Los pacientes que toman alfabloqueadores pueden expulsar sus cálculos en un período más corto de tiempo, pueden utilizar menos diclofenaco (que es un tipo de medicación para el dolor) y es probable que ingresen con menor frecuencia en el hospital. Entretanto, la necesidad de cirugía para los cálculos fue similar.
Una vez completados los análisis adicionales, se encontró que los efectos de los alfabloqueadores pueden ser diferentes en los pacientes con cálculos pequeños (5 mm o menos) versus más grandes (mayores de 5 mm). Al parecer esta medicación funciona mejor en los pacientes con cálculos más grandes. No fue posible encontrar diferencias en cuán bien funcionan los alfabloqueadores, sin importar en qué parte del uréter se atascó el cálculo o qué tipo de alfabloqueador se utilice.
Conclusiones de los autores
En los pacientes con cálculos atascados en el uréter, es probable que los alfabloqueadores faciliten la expulsión del cálculo, pero causan ligeramente más efectos no deseados. Al parecer los alfabloqueadores funcionan mejor en los pacientes con cálculos más grandes (mayores de 5 mm) en lugar de más pequeños (5 mm o menos).
Calidad de la evidencia
La calidad de la evidencia para la mayoría de los resultados fue moderada o baja, lo que significa que existe seguridad moderada o baja en la mayoría de los resultados presentados.
Conclusiones de los autores
Summary of findings
| Alpha‐blockers compared with standard therapy for ureteral stones | |||||
| Patient or population: adult patients presenting with symptoms of ureteral stone disease Setting: single or multicenter Intervention: alpha‐blocker Comparison: standard therapy | |||||
| Outcomes | No. of participants | Quality of the evidence | Relative effect | Anticipated absolute effects* (95% CI) | |
| Risk with standard therapy | Risk difference with alpha‐blockers | ||||
| Stone clearance | 10509 | ⊕⊕⊝⊝ | RR 1.45 | Study population | |
| 619 per 1000 | 278 more per 1000 | ||||
| Major adverse events | 3124 | ⊕⊕⊝⊝ | RR 1.25 | Study population | |
| 20 per 1000 | 5 more per 1000 | ||||
| Stone expulsion time | 6031 | ⊕⊕⊝⊝ | ‐ | MD 3.4 lower | |
| Pain episodes | 1363 | ⊕⊕⊝⊝ | ‐ | MD 0.66 lower | |
| Dose of diclofenac | 4373 | ⊕⊕⊝⊝ | ‐ | MD 82.41 mg lower | |
| Hospitalisation | 1876 | ⊕⊕⊕⊝ | RR 0.51 | Study population | |
| 141 per 1000 | 69 fewer per 1000 | ||||
| Surgical intervention | 3292 | ⊕⊕⊝⊝ | RR 0.74 | Study population | |
| 109 per 1000 | 28 fewer per 1000 | ||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence. | |||||
| aMost studies were rated as having high or unclear risk of bias. bClinically important heterogeneity with I² of 76%; provided rationale for downgrading together with suspected publication bias. cPublication bias suspected given funnel plot asymmetry. dConfidence interval consistent; no effect and clinically important harm. eClinically important heterogeneity with I² of 94%; provided rationale for downgrading together with suspected publication bias. fClinically important heterogeneity with I² of 80%; provided rationale for downgrading together with suspected publication bias. gClinically important heterogeneity with I² of 100%; provided rationale for downgrading together with suspected publication bias. | |||||
| Alpha‐blockers compared with placebo for ureteral stones | |||||
| Patient or population: adult patients presenting with symptoms of ureteral stone disease Setting: single or multicenter Intervention: alpha‐blocker Comparison: placebo | |||||
| Outcomes | No. of participants | Quality of the evidence | Relative effect | Anticipated absolute effects* (95% CI) | |
| Risk with placebo | Risk difference with alpha‐blockers | ||||
| Stone clearance | 5787 | ⊕⊕⊕⊝ | RR 1.16 | Study population | |
| 728 per 1000 | 116 more per 1000 | ||||
| Major adverse events | 1650 | ⊕⊕⊕⊝ | RR 2.09 | Study population | |
| 26 per 1000 | 29 more per 1000 | ||||
| Stone expulsion time | 3240 | ⊕⊕⊝⊝ | ‐ | MD 1.98 lower | |
| Pain episodes | 215 | ⊕⊕⊝⊝ | ‐ | MD 0.39 lower | |
| Dose of diclofenac (mg) | 3576 | ⊕⊕⊝⊝ | ‐ | MD 126.32 lower | |
| Hospitalisation | 500 | ⊕⊕⊕⊝ | RR 0.84 | Study population | |
| 96 per 1000 | 15 fewer per 1000 | ||||
| Surgical intervention | 1458 | ⊕⊕⊕⊕ | RR 0.93 | Study population | |
| 127 per 1000 | 9 fewer per 1000 | ||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence. | |||||
| aDowngraded owing to inconsistency (high heterogeneity with I² of 68%). bDowngraded owing to imprecision (wide confidence interval consistent with negligible to substantial harm). cDowngraded owing to inconsistency (heterogeneity with I² of 57%). dDowngraded owing to imprecision (wide confidence interval; wide confidence interval consistent with large to negligible benefit). eDowngraded owing to imprecision (wide confidence interval consistent with no effect and small benefit). fDowngraded owing to inconsistency (high heterogeneity with I² of 90%). | |||||
Antecedentes
Descripción de la afección
La enfermedad por cálculo urinario se refiere a la formación de piedras o cálculos en las vías urinarias y es uno de los motivos más frecuentes por el que los pacientes asisten a una consulta de urología; afecta a cerca del 5% al 10% de la población (Ramello 2000). Se ha informado una frecuencia incluso mayor de hasta el 12% en otras partes del mundo, y la enfermedad por cálculo es poco frecuente en solo algunas zonas geográficas (p.ej. Groenlandia, áreas costeras de Japón) (Tiselius 2003). Un estudio mostró un aumento de la prevalencia de por vida de la enfermedad por cálculo que varió del 7,14% al 11,62% durante un período de diez años (2000‐2010) (Turney 2011). Las tasas de incidencia y prevalencia de los cálculos renales pueden estar afectadas por factores genéticos, nutricionales y ambientales. Los hombres caucásicos tienen mayores probabilidades que los asiáticos, los hispanos y los afroestadounidenses de desarrollar cálculos urinarios (Pearle 2007). Además de la probabilidad de formación de cálculos, la composición y la ubicación de los cálculos en las vías urinarias pueden variar entre los países (Ramello 2000). Además, en los EE.UU. en el año 2000 se registraron más de 2 000 000 de visitas de pacientes ambulatorios por un diagnóstico primario de cálculos urinarios (UDA 2012). Las visitas al hospital de pacientes ambulatorios aumentaron en el 40% entre 1994 y 2000, y las visitas a los consultorios médicos aumentaron en el 43% entre 1992 y 2000. También en los EE.UU., el costo anual total calculado para la enfermedad por cálculo estuvo alrededor de USD $10 300 000 000 en 2006, lo que muestra un aumento de casi cinco veces en seis años (USD $2 100 000 000 en 2000) y representa un aumento del 50% desde 1994. En EE.UU. se observó un aumento adicional de los costos hasta más de USD 3 000 000 000 por visitas al servicio de urgencias en 2009 (Ghani 2014). Este aumento se podría explicar solo en parte por la mayor prevalencia de la enfermedad por cálculo (Pearle 2005).
La evolución natural de la enfermedad por cálculo urinario se caracteriza por pasos específicos, desde la formación de las placas de Randall hasta el desarrollo de cálculos que causan cólico renal o ureteral (Matlaga 2007). Los síntomas incluyen dolor lumbar o abdominal que se irradia a la ingle o a los genitales externos. Aunque algunos pacientes con cálculos ureterales pueden permanecer asintomáticos muchos presentan dolor, por lo que habitualmente buscan atención médica. Un episodio agudo de cólico es el resultado de un cálculo que se introduce en el uréter y provoca un aumento intermitente de la presión en el sistema pielocalicial. La mayoría de estos cálculos se expulsará de forma espontánea. El tamaño y la ubicación del cálculo son las dos variables predictivas más importantes para la expulsión del cálculo (Miller 1999). Se han informado tasas de expulsión del 68% para los cálculos menores de 5 mm y del 47% para los cálculos mayores de 5 mm y hasta 10 mm (Preminger 2007).
Las modalidades de tratamiento actual para los cálculos ureterales incluyen litotripsia extracorpórea con ondas de choque (ESWL, por sus siglas en inglés); ureteroscopia (flexible o semirrígida); nefrolitotomía percutánea; cirugía abierta, cirugía laparoscópica o cirugía asistida por robot; y observación con analgesia con o sin fármacos coadyuvantes para facilitar la expulsión de los cálculos (AUA Guideline 2016 Surgical Management of Stones; EAU guidelines on diagnosis and conservative management of urolithiasis 2016).
Según las guías de la European Association of Urology (EAU; las guías de la EAU para el diagnóstico y el tratamiento conservador de la urolitiasis 2016) y la American Urologic Association (AUA; AUA Guideline 2016 Surgical Management of Stones), en los pacientes con un cálculo ureteral recién diagnosticado de 10 mm o menos, en los que se controlan los síntomas, la observación con evaluación periódica es una opción para el tratamiento inicial. A estos pacientes se les puede ofrecer un tratamiento expulsivo médico apropiado para facilitar la expulsión de los cálculos durante el período de observación. Sin embargo, los pacientes deben estar informados acerca de los riesgos consiguientes del tratamiento expulsivo médico (que incluyen los efectos secundarios asociados con los fármacos) y se les debe comunicar que estos agentes se administran para su uso sin prescripción (Preminger 2007).
Descripción de la intervención
Se han evaluado diferentes modalidades de tratamiento expulsivo médico, que incluyen los alfabloqueadores, los bloqueadores de los canales de calcio, los corticosteroides y combinaciones de los anteriores. Sin embargo, la mayoría de la experiencia se ha adquirido con los alfabloqueadores (Hollingsworth 2006; Michel 2006; Singh 2007).
De qué manera podría funcionar la intervención
Los receptores α‐ y β‐adrenérgicos están presentes en el uréter humano, aunque predominan los receptores α. De manera más específica, los receptores α1 son importantes en la fisiología del uréter inferior y se han descubierto mayores densidades de receptores α1 en los uréteres inferiores de animales y seres humanos (Nakada 2008). En el uréter, los antagonistas de los receptores α1 inhiben el tono basal inicial y disminuyen la frecuencia y la amplitud de la peristalsis. Por lo tanto, la presión intraureteral podría disminuir y el transporte de líquidos podría aumentar, según los autores de algunos estudios (Morita 1987). Estos receptores parecen ser el objetivo ideal de la farmacoterapia, ya que representan el mayor impedimento para la expulsión del cálculo (Sterrett 2008). Varios ensayos en el pasado han evaluado los efectos de los alfabloqueadores; la mayoría informó efectos favorables sobre la expulsión de los cálculos. Se resumió esta información en la revisión anterior (Campschroer 2014).
Por qué es importante realizar esta revisión
Debido a las altas tasas de cálculos ureterales que se expulsan de manera espontánea, se justifica un estudio de tratamiento expulsivo médico. El tratamiento expulsivo médico efectivo tiene varios posibles efectos beneficiosos. Primero, puede disminuir la duración de los síntomas de los cálculos ureterales y, por lo tanto, la tasa de complicaciones como la infección urinaria (IU), la hidronefrosis y el deterioro de la función renal. Segundo, puede reducir de forma potencial la administración de intervenciones más invasivas como la ESWL y la ureteroscopia, y por lo tanto reducir la tasa de posibles complicaciones asociadas con estos procedimientos. Por último, es probable que el tratamiento expulsivo médico ahorre los limitados recursos de la asistencia sanitaria, como el tiempo de los médicos y las camas hospitalarias.
A pesar de la guía conjunta elaborada por la EAU y la AUA, persiste considerable controversia con respecto al mejor enfoque terapéutico para los cálculos ureterales y la efectividad de la administración de los alfabloqueadores como tratamiento expulsivo médico. Varios ensayos controlados aleatorios (ECA) publicados sobre este tema han presentado conclusiones contradictorias. Se preparó una revisión sistemática actualizada de todos los datos disponibles de ECA recientes, se utilizaron los estándares metodológicos más altos y se aplicó el enfoque GRADE para valorar la calidad de la evidencia.
En resumen, la combinación de los estudios realizados hasta el presente brinda la oportunidad de producir una estimación general del efecto de los alfabloqueadores como tratamiento expulsivo médico para los cálculos ureterales. La dirección y la magnitud de este efecto se pueden utilizar para guiar las decisiones acerca de la práctica clínica.
Esta revisión Cochrane actual presenta una actualización de la revisión Cochrane previa (Campschroer 2014). Desde la última búsqueda realizada (9 julio 2012), se han publicado varios estudios nuevos, lo que hace necesaria una actualización de esta revisión Cochrane.
Objetivos
Evaluar los efectos de los alfabloqueadores comparados con tratamiento estándar para los cálculos ureterales de 1 cm o menos confirmados mediante imagenología en pacientes adultos que presentan síntomas de la enfermedad por cálculo ureteral.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron todos los ECA y ensayos controlados cuasialeatorios (ensayos en los que los investigadores asignan a los participantes al tratamiento mediante alternancia, historias clínicas alternas, fecha de nacimiento u otros métodos previsibles) realizados para investigar los alfabloqueadores para el tratamiento de los pacientes adultos con cálculos ureterales. Se incluyeron estudios elegibles independientemente de su estado de publicación o idioma de publicación.
Tipos de participantes
Criterios de inclusión
-
Pacientes adultos (a partir de los 18 años de edad)
-
Síntomas de cálculos ureterales como dolor lumbar o abdominal, posible irradiación a la ingle o los genitales externos
-
Diagnóstico confirmado con imagenología (p.ej. radiografía simple de riñón, uréter y vejiga [RUV]); tomografía computarizada [TC]; pielografía intravenosa [PIV]; ecografía [US])
-
Medición única del cálculo de 10 mm o menos
Criterios de exclusión
-
Evidencia de IU o hidronefrosis con factores complicados (p.ej. sepsis, dolor no controlable, deterioro de la función renal)
-
Anomalías renales o ureterales (p.ej. único riñón, malformación ureteral)
-
Pacientes embarazadas o que lactan
-
Cálculos bilaterales
-
Estar tomando un alfabloqueador o un bloqueador de los canales de calcio, o presentar alergias a estos fármacos
Tipos de intervenciones
Las intervenciones incluyen tratamiento expulsivo médico con alfabloqueadores para tratar a los pacientes con cálculos ureterales versus uno de dos comparadores: (1) tratamiento estándar (p.ej. fármacos antiinflamatorios no esteroideos [AINE], corticosteroides, antiespasmódicos), o (2) placebo. Cuando un estudio evaluó múltiples alfabloqueadores, se combinaron los brazos para la comparación alfabloqueadores versus tratamiento estándar o placebo. Se realizaron análisis de subgrupos para explorar si los efectos variaron entre diversos alfabloqueadores.
Se excluyeron los estudios en los que los investigadores evaluaron los alfabloqueadores como coadyuvantes a la cirugía o la litotripsia. Si los pacientes utilizaron otra medicación como los anticolinérgicos o los antiespasmódicos como coadyuvantes a la medicación del ensayo, solo se evaluaron los grupos comparables (p.ej. pacientes en un grupo de tratamiento estándar que utilizaron anticolinérgicos versus pacientes en el grupo del ensayo que utilizaron anticolinérgicos combinados con la medicación del ensayo).
Tipos de medida de resultado
Resultados primarios
-
Expulsión de los cálculos (resultado dicotómico definido como porcentaje de participantes identificados como sin cálculo por imagenología el último día del ensayo, o participantes que no presentaban síntomas al final del ensayo, o participantes que habían expulsado el cálculo y los llevaron a la visita de seguimiento)
-
Eventos adversos graves (resultado dicotómico definido como número de participantes que presentaron hipotensión ortostática, colapso, síncope, palpitaciones o taquicardia)
Resultados secundarios
-
Tiempo transcurrido hasta la expulsión del cálculo (resultado continuo definido como días desde el comienzo de la inclusión hasta la expulsión del cálculo)
-
Episodios de dolor (resultado continuo definido como número de episodios de dolor)
-
Administración de diclofenaco (resultado continuo definido como dosis acumulativa de diclofenaco en miligramos)
-
Hospitalización (resultado dicotómico definido como porcentaje de participantes que necesitaron ingreso hospitalario debido a dolor no controlable o factores relacionados con complicaciones como IU o sepsis)
-
Intervención quirúrgica (resultado dicotómico definido como número de participantes que requieren intervención quirúrgica como resultado de dolor no controlado o hidronefrosis en el período del ensayo)
Resultados principales de las tablas "Resumen de los hallazgos"
Se presentan tablas "Resumen de los hallazgos" que informan los siguientes resultados, enumerados según la prioridad.
Comparación 1 (Análisis 1): alfabloqueadores versus tratamiento estándar o placebo (Tabla 1 Resumen de los hallazgos).
1.1 Expulsión del cálculo.
1.2 Eventos adversos graves.
1.3 Tiempo transcurrido hasta la expulsión del cálculo.
1.4 Episodios de dolor.
1.5 Dosis del diclofenaco (mg).
1.6 Hospitalización.
1.7 Intervención quirúrgica.
Métodos de búsqueda para la identificación de los estudios
Búsquedas electrónicas
We searched the Cochrane Renal Group Specialized Register for the first version of this Cochrane Review through contact with the Trial Search Co‐ordinator using search terms relevant to this review (search date 9 July 2012). TC and XZ updated the search on 18 November 2017, by using the following sources.
-
Cochrane Central Register of Controlled Trials (CENTRAL; 2017 November 18) in the Cochrane Library.
-
MEDLINE (via Ovid 1946 to 18 November 2017).
-
MEDLINE In‐Process & Other Non‐Indexed Citations (18 November 2017).
-
Embase (via Ovid 1980 to 18 November 2017).
-
PubMed (inception to November 2017) (18 November 2017).
-
International Clinical Trials Registry Platform (ICTRP) search portal (WHO ICTRP) and ClinicalTrials.gov (18 November 2017).
-
Proceedings of major (mainly renal and stone disease) conferences from 2005 to November 2017: EAU (European Association of Urology); AUA (American Urological Association); ESD (Experts in Stone Disease); WCE (World Congress of Endourology); and SIU (Société Internationale d'Urologie).
We imposed no restrictions, for example, on language or publication status for the searches described above.
See Appendix 1 for search terms used in strategies for this review.
Búsqueda de otros recursos
-
Reference lists of urology textbooks, review articles, and relevant studies. Furthermore, review authors scrutinised the reference lists of identified relevant studies for additional citations.
-
Letters sent to request information about unpublished or incomplete studies to investigators known to be involved in previous studies.
Obtención y análisis de los datos
Selección de los estudios
We used reference management software to identify and remove duplicate records (Endnote 2016). Two review authors (TC and XZ) independently assessed the titles and abstract of records identified in the search against the predefined inclusion criteria to determine which studies should be assessed in the full‐text evaluation. The same review authors (TC and XZ) investigated all records included in the title/abstract screening as full text, mapped records to studies, and classified studies as included studies, excluded studies, studies awaiting classification, or ongoing studies, in accordance with the criteria for each provided in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011). We resolved discrepancies through discussion or arbitration by a third review author (TL). If resolution of a disagreement was not possible, we designated the study as 'Awaiting classification' and contacted the study authors for clarification. We documented in Characteristics of excluded studies tables reasons for exclusion of studies that may have reasonably been expected to be included in the review.
We summarised in Characteristics of included studies tables relevant study characteristics, including sample size, gender of participants, stone size, and stone location. We have shown the flow of literature through the assessment process in a PRISMA flowchart (Figure 1).
Extracción y manejo de los datos
Two review authors (TC and XZ) independently carried out data extraction using standard data extraction forms. We tested the forms before implementation in the review. We translated studies reported in non‐English language journals before assessment. In the case that more than one publication of the same study existed, we grouped reports together and included the publication with the most complete data. If outcome data were available at multiple time points during follow‐up of one trial, we extracted solely outcomes with the longest follow‐up. We highlighted any discrepancies between published versions. We resolved disagreements by consulting with another review author (TL). For dichotomous outcomes, we extracted the number of participants with the specific outcome and the denominator of the total participants for whom the outcome was assessed at longest follow‐up. For continuous outcomes, we extracted the number of participants for whom the outcome was measured and determined the mean value and standard deviation (SD) for each outcome. We requested through written correspondence any further information required from the original author(s) and included in the review any relevant information obtained in this manner. When original trial author(s) did not respond to this correspondence, we excluded that study from the review.
Evaluación del riesgo de sesgo de los estudios incluidos
Review authors (TC and XZ) independently assessed the risk of bias of each included study. We resolved disagreements by consensus or by consultation with a third review author (TL).
Using the Cochrane 'Risk of bias' assessment tool (Higgins 2011), we assessed risk of bias using the following domains.
-
Random sequence generation (selection bias).
-
Allocation concealment (selection bias).
-
Blinding of participants and personnel (performance bias).
-
Blinding of outcome assessment (detection bias).
-
Incomplete outcome data (attrition bias).
-
Selective reporting (reporting bias).
-
Other sources of bias.
We judged risk of bias domains as 'low risk', 'high risk', or 'unclear risk' and evaluated individual bias items as described in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011). We have presented 'Risk of bias' summary figures to illustrate these findings (Figure 2 and Figure 3).
For performance bias (blinding of participants and personnel) and detection bias (blinding of outcome assessment), we evaluated the risk of bias separately for each outcome, and we grouped outcomes according to whether they were measured subjectively or objectively when reporting our findings in the 'Risk of bias' tables.
We also assessed attrition bias (incomplete outcome data) on an outcome‐specific basis and grouped outcomes with like judgements when reporting our findings in the 'Risk of bias' tables.
We further summarised risk of bias across domains for each outcome in each included study, as well as across studies and domains for each outcome.
For assessment of performance bias, we judged all outcomes to be equally susceptible to bias.
For assessment of detection bias, we defined the following endpoints as susceptible to bias (subjective).
-
Stone clearance.
-
Major adverse events.
-
Stone expulsion time.
-
Pain episodes.
For assessment of detection bias, we defined the following endpoints as not susceptible to bias (objective).
-
Dose of diclofenac.
-
Hospitalisation.
-
Surgical intervention.
We assessed risk of bias of included studies using the bias assessment tool provided by Higgins 2011 (see Appendix 2).
Medidas del efecto del tratamiento
We analysed all data using Review Manager version 5.3.
For dichotomous outcomes (stone clearance, major adverse events, hospitalisation, surgical intervention), we expressed results as risk ratios (RRs) with 95% confidence intervals (CIs). When we used continuous scales of measurement to assess effects of treatment (stone expulsion time, pain episodes, dose of diclofenac), we used mean differences (MDs) with 95% CIs if the same scales were used.
Cuestiones relativas a la unidad de análisis
The unit of analysis is the study. In studies that included more than two intervention groups (e.g. tamsulosin and alfuzosin, different dosages of the same alpha‐blocker), we collapsed the separate treatment arms into one for our main analysis. If intervention groups could not be separated, or if it was unclear whether studies from the same author with a trial period in the same year had overlapping participants, we asked trial authors to provide us the exact data separately. When we received no reaction or a denial on our request, we had to exclude the study.
Manejo de los datos faltantes
We did not impute any data, and we did not have sufficient information to perform an intention‐to‐treat analysis for all trials. We took this into account when we assessed risk of bias.
We requested by written or electronic correspondence any further information or clarification required from trial authors, and we included in the review relevant data obtained in this manner.
Evaluación de la heterogeneidad
We identified heterogeneity (inconsistency) through visual inspection of forest plots to assess the extent of overlap of CIs, and we used the I² statistic to quantify inconsistency across studies to assess the impact of heterogeneity on the meta‐analysis (Higgins 2002; Higgins 2003). We interpreted I² as follows.
-
0% to 40%: may not be important.
-
30% to 60%: may indicate moderate heterogeneity.
-
50% to 90%: may indicate substantial heterogeneity.
-
75% to 100%: considerable heterogeneity.
Evaluación de los sesgos de notificación
We attempted to obtain study protocols to assess studies for selective outcome reporting. If we included 10 or more studies investigating a particular outcome, we used funnel plots to assess small‐study effects. Several explanations can be offered for the asymmetry of a funnel plot, including true heterogeneity of effect with respect to trial size, poor methodological design (and hence bias of small trials), and publication bias. We therefore interpreted results with caution (Sterne 2001).
Síntesis de los datos
For dichotomous outcomes, we used the Mantel‐Haenszel method; for continuous outcomes, we used the inverse variance method; and for time‐to‐event outcomes, we used the generic inverse variance method. We used Review Manager software to perform analyses (Review Manager 2014).
Análisis de subgrupos e investigación de la heterogeneidad
We conducted the following subgroup analyses to explore possible sources of heterogeneity (e.g. participants, interventions).
-
Stone size (stones measuring 5 mm or smaller vs stones measuring 6 to 10 mm).
-
Stone location (distal ureter stones vs mid or proximal ureter stones).
-
Type of alpha‐blocker.
We used this rationale in performing the subgroup analyses mentioned above because previous studies suggested possible subgroup effects (Campschroer 2014; Hollingsworth 2016; Preminger 2007).
We limited outcomes for subgroup analyses to data available from the included studies (i.e. analyses were performed only when stratification according to our subgroups was provided).
Análisis de sensibilidad
We conducted the following sensitivity analyses to explore possible sources of heterogeneity in study design.
-
Solely placebo‐controlled trials, excluding trials with standard therapy as the control group.
-
Solely high‐quality trials, excluding trials with high risk of bias.
'Summary of findings' tables and application of GRADE
We presented the overall quality of evidence for each outcome according to the GRADE approach, which takes into account five criteria related not only to internal validity (risk of bias, inconsistency, imprecision, publication bias) but also to external validity (e.g. directness of results) (Guyatt 2008). Two review authors (TC and XZ) independently rated the quality of evidence for each outcome as 'high', 'moderate', 'low', or 'very low', and resolved discrepancies by consensus, or, if needed, by arbitration provided by a third review author (TL). We presented a summary of the evidence for main outcomes in a 'Summary of findings' table, which provides key information about the best estimate of the magnitude of effect in relative terms and absolute differences for each relevant comparison of alternative management strategies; numbers of participants and studies addressing each important outcome; and the rating of overall confidence in effect estimates for each outcome (Guyatt 2008; Schünemann 2006).
Results
Description of studies
Results of the search
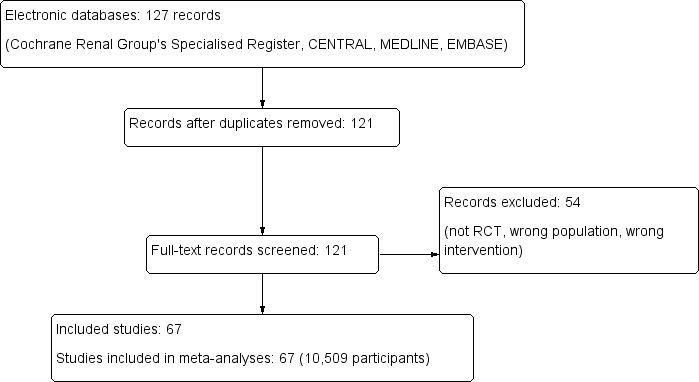
Initially, we found 127 records through database searching and identified no additional records through other sources. On the basis of our criteria, we identified 121 potentially relevant titles and retrieved the full text of these articles for further evaluation (Figure 1).
Included studies
Finally, we included 67 studies in this review (Characteristics of included studies).
Most studies (52 of 67) compared a standard therapy group versus an alpha‐blocker group. Standard therapy consisted of appropriate hydration and use of NSAIDs, corticosteroids, or antispasmodics. Fifteen of the 67 studies compared alpha‐blocker versus placebo. Ten of the 67 studies were carried out in a multi‐centre setting (Cho 2017; Dong 2009; Furyk 2016; Lee 2014; Lojanapiwat 2008; Meltzer 2017; Pickard 2015; Sur 2015; Vincendeau 2010; Ye 2017). Sample size varied from 30 to 3450 and mean or median age from 32 to 56 years, and the duration of follow‐up ranged from one week to eight weeks.
Some studies had multiple intervention arms (Agrawal 2009; Ahmed 2010; Albert 2016; Aldemir 2011; Balci 2014; Cha 2012; Dong 2009; El‐Gamal 2012; Erkan 2011; Erturhan 2007; Georgescu 2015; Hong 2008; Ibrahim 2013; Islam 2010; Kupeli 2004; Liatsikos 2007; Lojanapiwat 2008; Maitra 2012; Mshemish 2012; Mukhtarov 2007; Pickard 2015; Porpiglia 2006; Sen 2017; Taghavi 2005; Wang 2008a; Yilmaz 2005; Zhou 2011). Ten studies compared different alpha‐blockers, such as tamsulosin (0.4 mg), alfuzosin (10 mg), doxazosin (4 or 8 mg), terazosin (2 or 5 mg), naftopidil (10 mg), or silodosin (8 mg), with each other and with a standard therapy or placebo (Agrawal 2009; Ahmed 2010; Albert 2016; Cha 2012; Georgescu 2015; Ibrahim 2013; Mshemish 2012; Wang 2008a; Yilmaz 2005; Zhou 2011). Lojanapiwat 2008 and Cha 2012 used different dosages of tamsulosin (0.2 and 0.4 mg). Six studies used tamsulosin 0.2 mg (Cha 2012; Dong 2009; Han 2006a; Kaneko 2010; Kim 2007b; Lojanapiwat 2008).
Excluded studies
We excluded 54 studies (Characteristics of excluded studies).
Investigators in four studies gave participants calcium channel blockers, not alpha‐blockers (Borghi 1994; Cooper 2000; Porpiglia 2000; Skrekas 2003). Five studies treated participants with invasive treatment modalities (ureteral stent positioning, ESWL, or ureterorenoscopy with lithotripsy) (Agarwal 2009; Damiano 2008; Deliveliotis 2006; John 2010; Wang 2009c). We excluded eight studies because they included participants with ureteral stones larger than 10 mm, or with multiple stones (Aravinthan 2012; Avdoshin 2005; Dellabella 2003; Dellabella 2005; Gandhi 2013; Khawaja 2005; Mohseni 2006; Resim 2005). We could not compare study groups from 14 studies for this review, or investigators used no standard therapy/placebo (Cuni 2013; Dellabella 2005a; Gupta 2013; Gupta Shyam 2014; Gurbuz 2011; Imperatore 2014; Jayant 2014; Kumar 2014; Kumar 2015; Lu 2012; Morozumi 2013; Salem 2015; Shabana 2015; Tsuzaka 2011). We excluded nine studies because of study design (no RCTs) (Brausi 2015; Hwang 2012; Itano 2012; Loftus 2015; Moon 2015; Multescu 2014; Nasim 2014; Reddy 2016; Resorlu 2011; Shah 2013; Tchey 2011; Tsuzaka 2011; Vavassori 2012). Other reasons for exclusion were enrolment of children (Aydogdu 2009; Sameer 2014), insufficient recruitment (ISRCTN24675122), addition of corticosteroid drugs to tamsulosin (Dellabella 2005a), inclusion of patients with pyelonephritis (Chau 2011), and insufficient primary and secondary outcome data or data that could not be interpreted (Bak 2007; Bhat 2015; Haxhiu 2014; Ohgaki 2010; Ramesh 2015; Su 2016; Sumer 2012).
Risk of bias in included studies
Allocation
Of the 67 studies, 36 and 50 studies described methods of sequence generation and allocation, respectively, with unclear risk of selection bias. Twenty‐six and 15 studies had low risk of bias, respectively. We judged five and two studies as having high risk of bias, respectively.
Blinding
In total, we judged 48 and 56 studies as having unclear risk of performance and detection bias, respectively. Fourteen and 10 studies had low risk of bias, respectively. We judged five studies and one study as having high risk of bias, respectively.
Incomplete outcome data
In total, we judged 47 studies as having low risk of attrition bias. Twelve studies had unclear risk of bias. Eight studies had high risk of bias.
Selective reporting
The funnel plot as shown in Figure 4 was asymmetrical. Of the 67 included studies, we judged 42 as having low risk of reporting bias. Twelve studies had unclear risk of bias. Thirteen studies had high risk of bias.

Funnel plot of comparison: 1 Alpha‐blocker versus standard therapy or placebo, outcome: 1.1 Stone clearance.
Other potential sources of bias
In total, we considered 50 studies as having low risk of other potential sources of bias. Thirteen studies had unclear risk of bias. We judged four studies as having high risk of bias.
Effects of interventions
See: Summary of findings for the main comparison Alpha‐blockers compared with standard therapy for ureteral stones; Summary of findings 2 Alpha‐blockers compared with placebo for ureteral stones
1. Alpha‐blockers versus standard therapy or placebo
See summary of findings Table for the main comparison and summary of findings Table 2.
Primary outcomes
1.1 Stone clearance
A total of 67 RCTs with 10.509 participants showed that treatment with an alpha‐blocker may result in a large increase in stone clearance (Analysis 1.1; RR 1.45, 95% CI 1.36 to 1.55; P < 0.00001; I² = 76%; low‐quality evidence); this corresponds to 278 more (95% CI 223 more to 340 more) stone clearances per 1000. We downgraded the quality of evidence for study limitations, inconsistency, and concerns about publication bias.
1.2 Major adverse events
Eighteen studies with 3124 participants described major adverse events. Treatment with an alpha‐blocker may have little effect on major adverse events (Analysis 1.2; RR 1.25, 95% CI 0.80 to 1.96; P = 0.33; I² = 0%; low‐quality evidence); this corresponds to 5 more (95% CI 4 fewer to 19 more) major adverse events per 1000. We downgraded the quality of evidence for study limitations and imprecision.
Seven studies reported discontinuation of treatment due to adverse events (Hermanns 2009; Itoh 2011; Itoh 2013; Pedro 2008; Sen 2017; Sur 2015; Vincendeau 2010). In some studies, discontinuation of treatment due to adverse events was unclear (Meltzer 2017; Pickard 2015).
In total, 59 major adverse events occurred in 3124 participants receiving alpha‐blockers, and 28 major adverse events were reported in 1329 participants receiving standard therapy or placebo.
Eleven of 1735 participants (0.6%) in the alpha‐blocker group discontinued treatment within the study because of major adverse events, as compared with 1 of 1389 (0.07%) in the control group.
Secondary outcomes
1.3 Stone expulsion time
A total of 37 studies with 6031 participants described stone expulsion time. Treatment with an alpha blocker may substantially reduce the time to stone passage (Analysis 1.3; MD ‐3.40 days, 95% CI ‐4.17 to ‐2.63; P < 0.00001; I² = 94%; low‐quality evidence). We downgraded the quality of evidence for study limitations, inconsistency, and concerns about publication bias.
1.4 Pain episodes
A total of 15 studies with 1363 participants reported the number of pain episodes. Treatment with an alpha‐blocker may provide a small reduction in the number of pain episodes (Analysis 1.4; MD ‐0.66, 95% CI ‐0.91 to ‐0.42; P < 0.00001; I² = 80%; low‐quality evidence). We downgraded the quality of evidence for study limitations, inconsistency, and concerns about publication bias.
1.5 Dose of diclofenac
On the basis of 14 studies with 4373 participants, we are uncertain whether treatment with an alpha‐blocker reduces the use of diclofenac (Analysis 1.5; MD ‐82.41, 95% CI ‐122.51 to ‐42.31; P < 0.00001; I² = 100%; low‐quality evidence). It is notable that the dose of diclofenac in the standard therapy group varied largely among studies (from 15 mg to 1405 mg). We downgraded the quality of evidence for study limitations, inconsistency, and concerns about publication bias.
1.6 Hospitalisation
Findings of 13 studies with 1876 participants show that treatment with an alpha‐blocker may reduce the need for hospitalisation (Analysis 1.6; RR 0.51, 95% CI 0.34 to 0.77; P = 0.001; I² = 40%; moderate‐quality evidence). This corresponds to 69 fewer (95% CI 93 fewer to 32 fewer) hospitalisations per 1000. We downgraded the quality of evidence for study limitations.
1.7 Surgical intervention
A total of 19 studies with 3292 participants reported that treatment with an alpha‐blocker may have little effect on the need for surgical intervention (Analysis 1.7; RR 0.74, 95% CI 0.53 to 1.02; P = 0.07; I² = 37%; low‐quality evidence). This corresponds to 28 fewer (95% CI 51 fewer to 2 more) surgical interventions per 1000. We downgraded the quality of evidence for study limitations and imprecision.
Subgroup analyses
Stone size
2.1 Stone clearance
We compared outcomes of participants with stones measuring 5 mm or smaller (14 studies, 2622 participants) versus outcomes of those with stones bigger than 5 mm (10 studies, 2887 participants; Analysis 2.1). We found an RR of 1.06 (95% CI 0.98 to 1.15; P = 0.16; I² = 62%) versus 1.45 (95% CI 1.22 to 1.72; P < 0.0001; I² = 59%), respectively. The test for interaction was suggestive of a possible subgroup effect (Chi² = 9.96, P = 0.002; I² = 90%). Therefore, alpha‐blockers may have little effect on stone clearance in participants with stones measuring 5 mm or smaller, resulting in 48 more (95% CI 16 fewer to 121 more) stone clearances per 1000, but may substantially increase stone clearance in participants with stones bigger than 5 mm, which corresponds to 302 more (95% CI 148 more to 483 more) stone clearances per 1000. We rated the quality of evidence as moderate upon downgrading for study limitations and imprecision.
2.2 Stone expulsion time
Stratified by stone size, participants with stones measuring 5 mm or smaller did benefit from using alpha‐blockers compared with standard therapy or placebo in terms of stone expulsion time (Analysis 2.2; six studies, 1264 participants) (MD ‐1.07, 95% CI ‐1.99 to ‐0.15; P = 0.02; I² = 60%). The quality of evidence was low upon downgrading for risk of bias, inconsistency, and imprecision. For stones bigger than 5 mm, the alpha‐blocker group had shorter stone expulsion time (Analysis 2.2; four studies, 1884 participants) (MD ‐5.99, 95% CI ‐7.16 to ‐4.82; P < 0.00001; I² = 77%). The quality of evidence was low upon downgrading for risk of bias, inconsistency, and imprecision.
The subgroup interaction test did not indicate a difference in effect for stone expulsion time based on stone size (Chi² = 41.91, P < 0.00001; I² = 97.6%).
2.3 Other outcomes
We found no studies that reported the outcomes of major adverse events, pain episodes, dose of diclofenac, hospitalisation, and surgical intervention that permitted an analysis stratified by stone size.
Stone location
3.1 Stone clearance
For participants with distal ureteral stones, stone clearance may be improved (Analysis 3.1; 57 studies, 8576 participants) (RR 1.46, 95% CI 1.36 to 1.57; P < 0.00001; I² = 77%). The quality of evidence was low upon downgrading for risk of bias, inconsistency, and publication bias.
For participants with mid and proximal ureteral stones, stone clearance was similar (Analysis 3.1; nine studies, 794 participants) (RR 1.28, 95% CI 0.99 to 1.66; P = 0.06; I² = 60%). The quality of evidence was low upon downgrading for risk of bias, inconsistency, and imprecision.
Tests for subgroup differences were not statistically significant (Chi² = 0.93, I² = 0%, P = 0.34).
3.2 Stone expulsion time
Participants with distal ureteral stones may benefit from using alpha‐blockers compared with standard therapy or placebo in terms of stone expulsion time (Analysis 3.2; 32 studies, 5453 participants) (MD ‐3.43, 95% CI ‐4.26 to ‐2.60; P < 0.0001; I² = 95%). The quality of evidence was low upon downgrading for risk of bias, inconsistency, and imprecision. For mid or proximal ureteral stones, the alpha‐blocker group did not show shorter stone expulsion time (Analysis 3.2; two studies, 146 participants) (MD ‐8.64, 95% CI ‐19.75 to 2.48; P = 0.13; I² = 96%). The quality of evidence was moderate upon downgrading for risk of bias and imprecision.
The subgroup interaction test indicated a difference in effect for stone expulsion time based on stone location (Chi² = 0.84, P = 0.36, I² = 0%).
3.3 Other outcomes
We found no studies that reported the outcomes of major adverse events, pain episodes, dose of diclofenac, hospitalisation, and surgical intervention that permitted an analysis stratified by stone location.
Type of alpha‐blocker
4.1 Stone clearance
We performed a subgroup analysis based on types of alpha‐blockers used; these included tamsulosin, alfusozin, terazosin, naftopidil, and silodosin (Analysis 4.1). All types of alpha‐blockers improved stone clearance. The subgroup test for interaction did not show significance (Chi² = 1.44, I² = 0%, P = 0.92).
4.2 Major adverse events
We performed a subgroup analysis based on types of alpha‐blockers used; these included tamsulosin, alfusozin, doxasozin, terazosin, naftopidil, and silodosin (Analysis 4.2). Major adverse events were not increased, except with alfuzosin (five studies, 323 participants) (RR 5.51, 95% CI 1.46 to 20.83; P = 0.01; I² = 0%). However, the subgroup test for interaction did not show significance (Chi² = 5.57, I² = 46.1%, P = 0.13).
4.3 Stone expulsion time
We performed a subgroup analysis based on types of alpha‐blockers used; these included tamsulosin, alfusozin, terazosin, naftopidil, and silodosin (Analysis 4.3). Use of an alpha‐blocker consistently shortened time to stone passage. The subgroup test for interaction did not show significance (Chi² = 23.76, I² = 79.0%, P = 0.0002).
4.4 Pain episodes
We performed a subgroup analysis based on types of alpha‐blockers used; these included tamsulosin, alfusozin, doxasozin, terazosin, naftopidil, and silodosin (Analysis 4.4). Pain episodes were consistently decreased, except with silodosin (two studies, 150 participants) (MD ‐0.89, 95% CI ‐2.05 to 0.26; P = 0.13; I² = 80%). The subgroup test for interaction did not show significance (Chi² = 3.02, I² = 0%, P = 0.70).
4.5 Dose of diclofenac (mg)
We performed a subgroup analysis based on types of alpha‐blockers used; these included tamsulosin, doxasozin, terazosin, and silodosin (Analysis 4.5). Diclofenac use was consistently decreased. The subgroup test for interaction did not show significance (Chi² = 1.37, I² = 0%, P = 0.71).
4.6 Hospitalisation
Tamsulosin versus standard therapy or placebo showed fewer hospitalisations in favour of alpha‐blockers (Analysis 4.6; 11 studies, 1606 participants) (RR 0.57, 95% CI 0.38 to 0.86; P = 0.007; I² = 33%). The risk difference for participants receiving tamsulosin was 58 fewer more (95% CI 19 fewer to 84 fewer) hospitalisations per 1000. The quality of evidence was moderate upon downgrading for risk of bias.
Alfuzosin did not show a beneficial effect in the alpha‐blocker group in terms of hospitalisation (Analysis 4.6; two studies, 110 participants) (RR 0.35, 95% CI 0.09 to 1.45; P = 0.15; I² = 0%). The risk difference for participants receiving alfuzosin was 84 fewer (95% CI 118 fewer to 58 more) hospitalisations per 1000. The quality of evidence was low upon downgrading for risk of bias and imprecision.
Use of doxazosin did not result in fewer hospitalisations (Analysis 4.6; two studies, 132 participants) (RR 0.19, 95% CI 0.01 to 3.05; P = 0.24; I² = 78%). The risk difference for participants receiving doxazosin was 282 fewer (95% CI 345 fewer to 714 more) hospitalisations per 1000. The quality of evidence was low upon downgrading for risk of bias, inconsistency, and imprecision.
Silodosin versus standard therapy or placebo showed fewer hospitalisations in the alpha‐blocker group (Analysis 4.6; two studies, 180 participants) (RR 0.26, 95% CI 0.12 to 0.55; P = 0.0005; I² = 0%). The risk difference for participants receiving silodosin was 222 fewer (95% CI 135 fewer to 264 fewer) hospitalisations per 1000. The quality of evidence was moderate upon downgrading for risk of bias.
Testing for subgroup differences was not statistically significant (Chi² = 3.77, I² = 20.4%, P = 0.29).
4.7 Surgical intervention
Use of tamsulosin did not lead to fewer surgical interventions (Analysis 4.7; 16 studies, 2820 participants) (RR 0.82, 95% CI 0.59 to 1.13; P = 0.22; I² = 29%). The risk difference for participants receiving tamsulosin was 21 fewer (95% CI 49 fewer to 15 more) surgical interventions per 1000. The quality of evidence was moderate upon downgrading for risk of bias.
Alfuzosin did not result in less surgical interventions (Analysis 4.7; one study, 58 participants) (RR 0.47, 95% CI 0.09 to 2.35, P = 0.36). The risk difference for participants receiving alfuzosin was 76 fewer (95% CI 130 fewer to 193 more) surgical interventions per 1000. The quality of evidence was low upon downgrading for risk of bias and imprecision.
Use of doxazosin did not result in fewer surgical interventions (Analysis 4.7; two studies, 133 participants) (RR 0.41, 95% CI 0.15 to 1.11; P = 0.08; I² = 0%). The risk difference for participants receiving doxazosin was 89 fewer (95% CI 128 fewer to 17 more) surgical interventions per 1000. The quality of evidence was low upon downgrading for risk of bias and imprecision.
Data show no difference in terms of surgical interventions between silodosin versus standard therapy or placebo (Analysis 4.7; three studies, 133 participants) (RR 0.41, 95% CI 0.15 to 1.11; P = 0.11; I² = 27%). The risk difference for participants receiving silodosin was 25 fewer (95% CI 33 fewer to 11 more) surgical interventions per 1000. The quality of evidence was low upon downgrading for risk of bias and imprecision.
Testing for subgroup differences did not show statistical significance (Chi² = 3.52, I² = 14.9%, P = 0.32).
Sensitivity analyses
Alpha‐blockers versus placebo
5.1 Stone clearance
Participants who received alpha‐blockers were more likely to be stone‐free compared with those who received placebo (Analysis 5.1; 15 studies, 5787 participants) (RR 1.16, 95% CI 1.07 to 1.25, P <0.00001; I² = 68%). The risk difference with alpha‐blockers was 116 more (95% CI 51 more to 182 more) stone clearances per 1000. The quality of evidence was moderate upon downgrading for risk of bias and inconsistency.
5.2 Major adverse events
Participants using alpha‐blockers experienced more major adverse events of the medication compared with those given placebo (Analysis 5.2; 10 studies, 1650 participants) (RR 2.09, 95% CI 1.13 to 3.86; P = 0.02; I²= 25%). The risk difference with alpha‐blockers was 29 more (95% CI 3 more to 75 more) major adverse events per 1000. The quality of evidence was moderate upon downgrading for risk of bias and imprecision. For 4 of the 848 (0.47%) participants in the alpha‐blocker group, the major adverse event led to cessation of therapy versus none in the placebo group.
5.3 Stone expulsion time
Stone expulsion time was shorter among participants using alpha‐blockers compared with those receiving placebo (Analysis 5.3; seven studies, 3240 participants) (MD ‐1.98, 95% CI ‐3.71 to ‐0.24; P = 0.03; I² = 76%). The quality of evidence was low upon downgrading for inconsistency and imprecision.
5.4 Pain episodes
The number of pain episodes was not statistically different between participants using alpha‐blockers and those receiving placebo (Analysis 5.4; two studies, 215 participants) (MD ‐0.39, 95% CI ‐1.07 to 0.29; P = 0.13; I² = 57%). The quality of evidence was low upon downgrading for inconsistency and imprecision.
5.5 Dose of diclofenac (mg)
The dose of diclofenac used was statistically lower for participants using alpha‐blockers compared with those receiving placebo (Analysis 5.5; four studies, 3576 participants) (MD ‐126.32, 95% CI ‐181.73 to ‐70.90; P < 0.00001; I² = 90%). The quality of evidence was low upon downgrading for risk of bias, inconsistency, and imprecision.
5.6 Hospitalisation
Hospitalisation was not statistically different between participants using alpha‐blockers and those receiving placebo (Analysis 5.6; two studies, 500 participants) (RR 0.84, 95% CI 0.48 to 1.47; P = 0.55; I² = 0%). The risk difference with alpha‐blockers was 15 fewer (95% CI 50 fewer to 45 more) hospitalisations per 1000. The quality of evidence was moderate upon downgrading for risk of bias and imprecision.
5.7 Surgical intervention
Surgical intervention was not statistically different between participants using alpha‐blockers and those receiving placebo (Analysis 5.7; five studies, 1458 participants) (RR 0.93, 95% CI 0.70 to 1.24; P = 0.39; I² = 1%). The risk difference with alpha‐blockers was 9 fewer (95% CI 38 fewer to 30 more) surgical interventions per 1000. The quality of evidence was high.
High‐quality studies
6.1 Stone clearance
Data show statistically significant higher stone clearance between intervention and control groups in the high‐quality sensitivity analysis (Analysis 6.1; five studies, 4133 participants) (RR 1.09, 95% CI 1.06 to 1.13; P < 0.00001; I² = 0%). The risk difference with alpha‐blockers was 68 more (95% CI 45 more to 98 more) stone clearances per 1000. The quality of evidence was high.
6.2 Major adverse events
Participants using alpha‐blockers did not experience more major adverse events of the medication compared with those given placebo (Analysis 6.2; two studies, 515 participants) (RR 0.94, 95% CI 0.51 to 1.72; P = 0.84; I²= 0%). The risk difference with alpha‐blockers was 5 fewer (95% CI 38 fewer to 56 more) major adverse events per 1000. The quality of evidence was moderate upon downgrading for imprecision.
6.3 Stone expulsion time
Stone expulsion time was not statistically different between participants using alpha‐blockers and those receiving placebo (Analysis 6.3; three studies, 2891 participants) (MD ‐1.72, 95% CI ‐5.13 to 1.68; P = 0.32; I² = 86%). The quality of evidence was low upon downgrading for inconsistency and imprecision.
6.4 Pain episodes
The number of pain episodes was not statistically different between participants using alpha‐blockers and those given placebo (Analysis 6.4; one study, 119 participants) (MD 0.00, 95% CI ‐0.72 to 0.72; P = 1). The quality of evidence was moderate upon downgrading for imprecision.
6.5 Dose of diclofenac (mg)
The dose of diclofenac used was statistically lower among participants using alpha‐blockers compared with those receiving placebo (Analysis 6.5; two studies, 3386 participants) (MD ‐173.28, 95% CI ‐277.60 to ‐68.95; P = 0.001). The quality of evidence was moderate upon downgrading for imprecision.
6.6 Hospitalisation
Hospitalisation was not statistically different between participants using alpha‐blockers and those receiving placebo (Analysis 6.6; one study, 403 participants) (RR 0.87, 95% CI 0.49 to 1.52; P = 0.62). The risk difference with alpha‐blockers was 15 fewer (95% CI 58 fewer to 60 more) hospitalisations per 1000. The quality of evidence was moderate upon downgrading for imprecision.
6.7 Surgical intervention
Surgical intervention was not statistically different between participants using alpha‐blockers and those receiving placebo (Analysis 6.7; three studies, 605 participants) (RR 0.94, 95% CI 0.38 to 2.32; P = 0.90; I² = 34%). The risk difference with alpha‐blockers was 3 fewer (95% CI 33 fewer to 70 more) surgical interventions per 1000. The quality of evidence was moderate upon downgrading for imprecision.
Discusión
Resumen de los resultados principales
Los resultados principales de este metanálisis son que es posible lograr una mayor expulsión de los cálculos con el tratamiento expulsivo médico con un alfabloqueador en comparación con el tratamiento estándar sin un alfabloqueador (evidencia de baja calidad). La administración de alfabloqueadores no parece dar lugar a un aumento de los eventos adversos graves (evidencia de baja calidad).
Según un análisis de sensibilidad preplanificado de los estudios controlados con placebo solamente, se encontró que los alfabloqueadores son menos efectivos que lo que indica el análisis general de todos los estudios; este hallazgo corresponde a una mayor expulsión de cálculos (evidencia de calidad moderada) y a un aumento de los eventos adversos graves (evidencia de calidad moderada).
El análisis de subgrupos predeterminado realizado apoyó un posible efecto de subgrupos según el tamaño del cálculo; los alfabloqueadores pueden proporcionar una mejoría clínicamente significativa en la expulsión de los cálculos entre los pacientes con cálculos que miden de 6 a 10 mm, pero no entre los pacientes con cálculos que miden 5 mm o menos. No se encontró evidencia de un efecto de subgrupo según la ubicación del cálculo ni el tipo de alfabloqueador.
Para los resultados secundarios, el tratamiento con alfabloqueadores parece acortar el tiempo transcurrido hasta la expulsión del cálculo y reducir el número de episodios de dolor, la administración de diclofenaco y la necesidad de hospitalización (calidad de la evidencia de muy baja a moderada). Los análisis de subgrupos mostraron un posible efecto de subgrupos relacionado con el tamaño del cálculo según la prueba de interacción, que indicó un efecto mayor en los cálculos que medían de 6 a 10 mm. Para la ubicación del cálculo y el tipo de alfabloqueador, la prueba de diferencias de subgrupos no mostró significación estadística.
Compleción y aplicabilidad general de las pruebas
Para esta revisión, se realizó una búsqueda exhaustiva: Dos de los tres autores de la revisión extrajeron y manejaron de forma independiente los datos de los ensayos y resolvieron los desacuerdos en consulta con el tercer autor de la revisión. Para recopilar posibles artículos de revistas útiles adicionales, no se tradujeron revistas en idioma diferente del inglés, y se les solicitó a los autores de los estudios con datos faltantes que facilitaran dichos datos mediante correspondencia escrita.
Se evaluó el riesgo de sesgo utilizando la herramienta de evaluación "Riesgo de sesgo" de Cochrane y se evaluó la calidad de la evidencia (ver a continuación) mediante el enfoque GRADE. Se debe señalar que, según la asimetría del gráfico en embudo (funnel plot), se sospechó sesgo de publicación para varios resultados, lo que dio lugar a la disminución de la calidad de la evidencia.
El seguimiento incluyó el examen radiológico en 50 de 67 estudios (74,6%). Cuatro estudios (6,3%) no realizaron evaluación radiológica y en 13 estudios (20,3%) no estuvo claro si se realizó. Se considera que se justifica la confirmación radiológica para evaluar la expulsión de los cálculos, aunque la revisión de las imágenes por los radiólogos (especialmente si no están cegados) puede haber introducido sesgo.
Debido a que los estudios se realizaron en una variedad amplia de países en todo el mundo y en varios continentes (es decir, América del Norte, Europa y Asia), los resultados de esta revisión probablemente sean aplicables en todo el mundo.
Además, es importante señalar el posible problema del informe incompleto de los eventos adversos graves.
Calidad de la evidencia
Se utilizó GRADE para evaluar la calidad de la evidencia por resultado y con frecuencia se disminuyó la calidad de la evidencia. Los problemas principales por los que disminuyó la seguridad en las estimaciones del efecto fueron las limitaciones de los estudios, específicamente la ocultación incierta de la asignación, la falta de cegamiento que dio lugar a sesgo de realización y detección y al posible sesgo de desgaste.
Otros problemas que con frecuencia dieron lugar a la disminución de la calidad fueron la inconsistencia clínicamente importante en los resultados de los estudios, la imprecisión y las inquietudes sobre el posible sesgo de publicación, al considerar la asimetría observada en el gráfico en embudo.
Por último, la mayoría de los estudios no estratificaron de manera prospectiva por subgrupos clínicamente importantes al momento de la asignación al azar; por lo que no está claro si existió un equilibrio pronóstico. Por lo tanto, los resultados de estos análisis secundarios se deben interpretar con precaución.
Sesgos potenciales en el proceso de revisión
Se hicieron búsquedas sin restricciones de idioma. Sin embargo, a pesar de los esfuerzos, que incluyeron establecer contacto con los investigadores principales de los estudios existentes, se pueden haber pasado por alto algunos estudios publicados en revistas no indizadas o que no se publicaron.
El sesgo de informe se investigó mediante los gráficos en embudo, que mostraron asimetría para la expulsión de los cálculos y los eventos adversos graves (Figura 4; Figura 5; Figura 6). Se realizaron análisis de sensibilidad después de la exclusión de los ensayos no controlados con placebo y todavía se encontró un efecto favorable de los alfabloqueadores sobre la expulsión de los cálculos cuando se sospechó sesgo de publicación.
Acuerdos y desacuerdos con otros estudios o revisiones
Aunque muchas revisiones sistemáticas han examinado este tema, se han realizado muy pocas con el mismo rigor metodológico estándar de las revisiones Cochrane. Esta revisión es la más actualizada e incluye el estudio no publicado y relativamente grande presentado por Meltzer y colegas en AUA 2017 (Meltzer 2017).
La mayoría de los ensayos anteriores que examinaron los alfabloqueadores para los cálculos ureterales concluyeron que mejoran la expulsión de los cálculos y el tiempo de expulsión de los cálculos. De 2013 a 2015 se han realizado múltiples metanálisis para diferentes alfabloqueadores (tamsulosina, silodosina y alfuzosina; Fan 2013; Huang 2015; Liu 2015, respectivamente) y esos resultados fueron similares a los resultados que se presentan en esta revisión. En un metanálisis realizado en 2016 por Hollingsworth y colegas (Hollingsworth 2016), los autores de la revisión obtuvieron resultados principales similares a los de la presente revisión, y señalaron que el uso de los alfabloqueadores se debe considerar en los pacientes con cálculos ureterales. El metanálisis de Hollingsworth incluyó algunos ensayos aleatorios multicéntricos controlados con placebo que no demostraron efectos beneficiosos de los alfabloqueadores en la expulsión de los cálculos, en comparación con placebo (Furyk 2016; Pickard 2015; Sur 2015). En el metanálisis actual también se incluyeron estos estudios. Dos de estos ensayos incluyeron un porcentaje grande de pacientes con cálculos pequeños (el 75% de los pacientes que tomaron alfabloqueadores tenían cálculos que medían 5 mm o menos) (Furyk 2016; Pickard 2015). Sin embargo, debido a que es más probable que los cálculos más pequeños se expulsen de manera espontánea (incluso sin tratamiento expulsivo médico), este hecho podría haber influido en el efecto general observado en estos estudios (es decir, los posibles efectos beneficiosos del tratamiento expulsivo médico pueden haberse diluido por la inclusión de cálculos más pequeños en estos dos estudios). El análisis más minucioso de los datos de Furyk y colegas muestra un efecto favorable en el grupo de tamsulosina versus el grupo placebo para los cálculos que miden 5 a 10 mm. La presente revisión respalda este resultado, ya que los ensayos incluidos informaron efectos significativos de los alfabloqueadores en los pacientes con cálculos más grandes (6 mm o más grande) en cuanto a la expulsión de los cálculos y a las posibles diferencias en el efecto detectadas mediante la prueba de interacción de subgrupos.
El ensayo SUSPEND realizado por Pickard y colegas se diseñó para evaluar la efectividad clínica del tratamiento expulsivo médico en lugar de la eficacia terapéutica, ya que la evaluación radiológica no fue una variable principal de evaluación (Pickard 2015). Aunque estos autores concluyeron que el tratamiento expulsivo médico no es efectivo para la reducción de la necesidad de intervención a las cuatro semanas, las diferencias en la expulsión de los cálculos se atenuaron para los cálculos mayores de 5 mm, lo que favorece a tamsulosina en comparación con nifedipino y placebo (71,3%, 61,7%, y el 60,6%, respectivamente). Además, la tasa de respuesta de los cuestionarios a las cuatro semanas (62%) y a las 12 semanas (49%) fue considerablemente menor que la observada en la participación en el resultado primario, pero pudo haber influido en los resultados secundarios. Los investigadores del ensayo SUSPEND no monitorizaron el cumplimiento con la medicación, lo que podría plantear algunas inquietudes. Los resultados del ensayo SUSPEND pueden haber dado lugar a cambios en la práctica clínica en algunos países. Sin embargo, este hecho no es consistente con los hallazgos derivados del presente metanálisis, que demostró un efecto beneficioso persistente de los alfabloqueadores en los cálculos ureterales distales mayores de 5 mm. Consistentes con el ensayo SUSPEND, los datos no muestran diferencias en las intervenciones quirúrgicas entre los grupos. Según los resultados del ensayo SUSPEND, una proporción muy pequeña de los participantes que recibieron alfabloqueadores presentaron eventos adversos graves, e incluso una pequeña proporción interrumpió el tratamiento por ese motivo.
Sur y colegas encontraron un efecto positivo de los alfabloqueadores en los pacientes con cálculos ureterales distales al realizar un análisis de subgrupos (Sur 2015). Lo anterior coincide con los hallazgos de la presente revisión (es decir, que el efecto mayor de los alfabloqueadores puede ocurrir en la porción distal del uréter y se puede lograr en los pacientes con cálculos que miden entre 6 y 10 mm).
Más recientemente se presentó un resumen en AUA 2017 que informó un ensayo incluido en el presente metanálisis (Meltzer 2017). Estos autores tampoco lograron demostrar un efecto favorable de los alfabloqueadores. Sin embargo, los investigadores evaluaron la expulsión de los cálculos mediante llamadas telefónicas y mediante informes de los participantes. Cerca del 50% de los participantes fueron sometidos a tomografía computarizada (TC) de seguimiento que no mostró diferencias en la expulsión de los cálculos entre los grupos. En este ensayo cerca del 75% de los participantes presentaron cálculos menores de 5 mm; no hay resultados de los análisis de subgrupos según el tamaño del cálculo disponibles para este estudio no publicado. Aparte de anomalías de la eyaculación, no ocurrieron eventos adversos relacionados con el tratamiento con mayor frecuencia en el grupo de alfabloqueador.
El artículo publicado más recientemente describe los efectos favorables de tamsulosina informados por Ye y colegas para el ensayo más grande hasta el momento, (Ye 2017). Este estudio doble ciego controlado con placebo que incluyó cálculos distales demostró un efecto beneficioso específico de tamsulosina para los cálculos más grandes (> 5 mm), aunque los autores del ensayo no presentaron los resultados de la prueba de interacción. Los datos no muestran diferencias en la incidencia de eventos adversos entre los dos grupos de estudio, y los investigadores no informaron eventos adversos graves. Estos resultados están apoyados por la característica única de este estudio de que los participantes fueron sometidos a tomografías computarizadas sin contraste semanales.
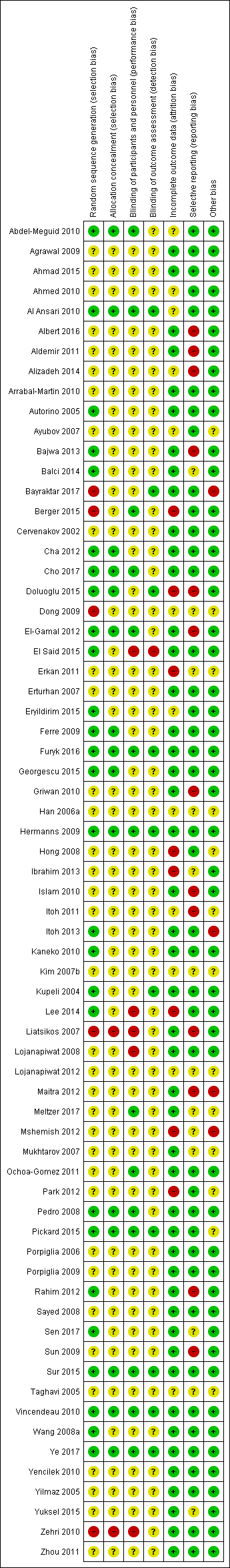
Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Funnel plot of comparison: 1 Alpha‐blocker versus standard therapy or placebo, outcome: 1.1 Stone clearance.
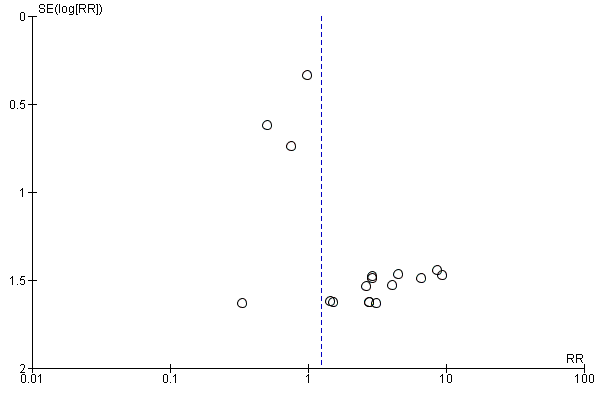
Funnel plot of comparison: 1 Alpha‐blocker versus standard therapy or placebo, outcome: 1.2 Major adverse events.

Funnel plot of comparison 2: Alpha‐blocker versus placebo, outcome: 2.2 Major adverse events.

Comparison 1 Alpha‐blocker versus standard therapy or placebo, Outcome 1 Stone clearance.
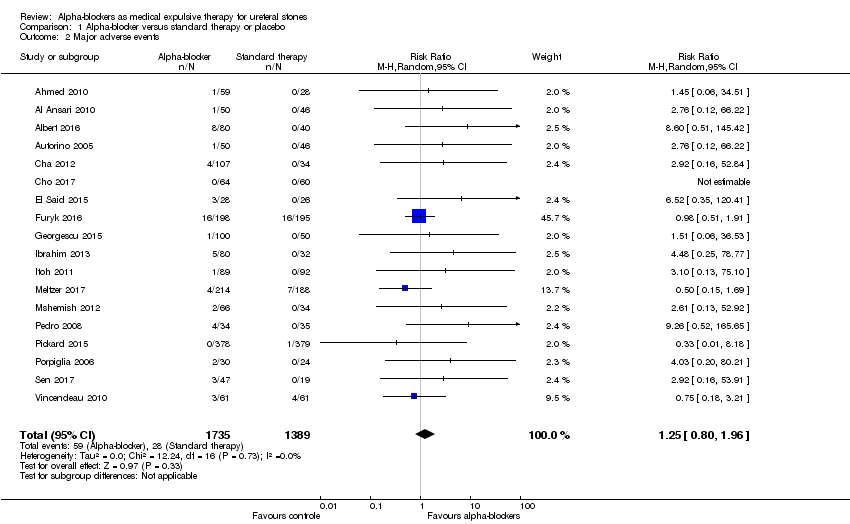
Comparison 1 Alpha‐blocker versus standard therapy or placebo, Outcome 2 Major adverse events.

Comparison 1 Alpha‐blocker versus standard therapy or placebo, Outcome 3 Stone expulsion time.
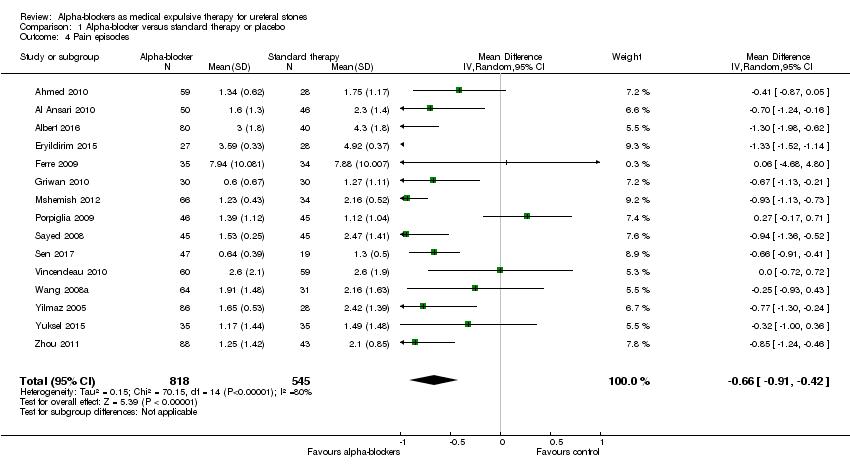
Comparison 1 Alpha‐blocker versus standard therapy or placebo, Outcome 4 Pain episodes.

Comparison 1 Alpha‐blocker versus standard therapy or placebo, Outcome 5 Dose of diclofenac.

Comparison 1 Alpha‐blocker versus standard therapy or placebo, Outcome 6 Hospitalisation.

Comparison 1 Alpha‐blocker versus standard therapy or placebo, Outcome 7 Surgical intervention.

Comparison 2 Subgroup analysis 1: stones measuring 5 mm or less versus stones measuring 6 to 10 mm, Outcome 1 Stone clearance.

Comparison 2 Subgroup analysis 1: stones measuring 5 mm or less versus stones measuring 6 to 10 mm, Outcome 2 Stone expulsion time.

Comparison 3 Subgroup analysis 2: distal ureter versus mid or proximal ureter stones, Outcome 1 Stone clearance.

Comparison 3 Subgroup analysis 2: distal ureter versus mid or proximal ureter stones, Outcome 2 Stone expulsion time.
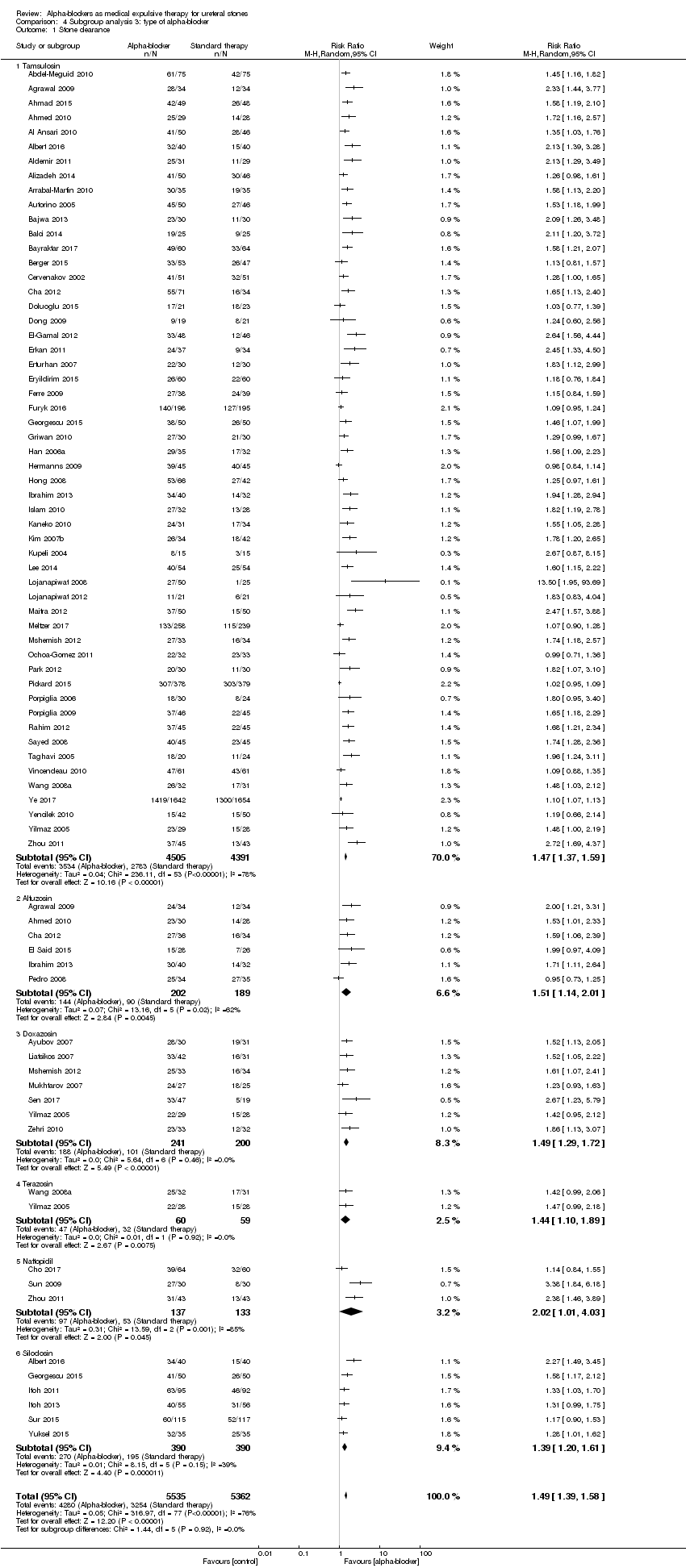
Comparison 4 Subgroup analysis 3: type of alpha‐blocker, Outcome 1 Stone clearance.
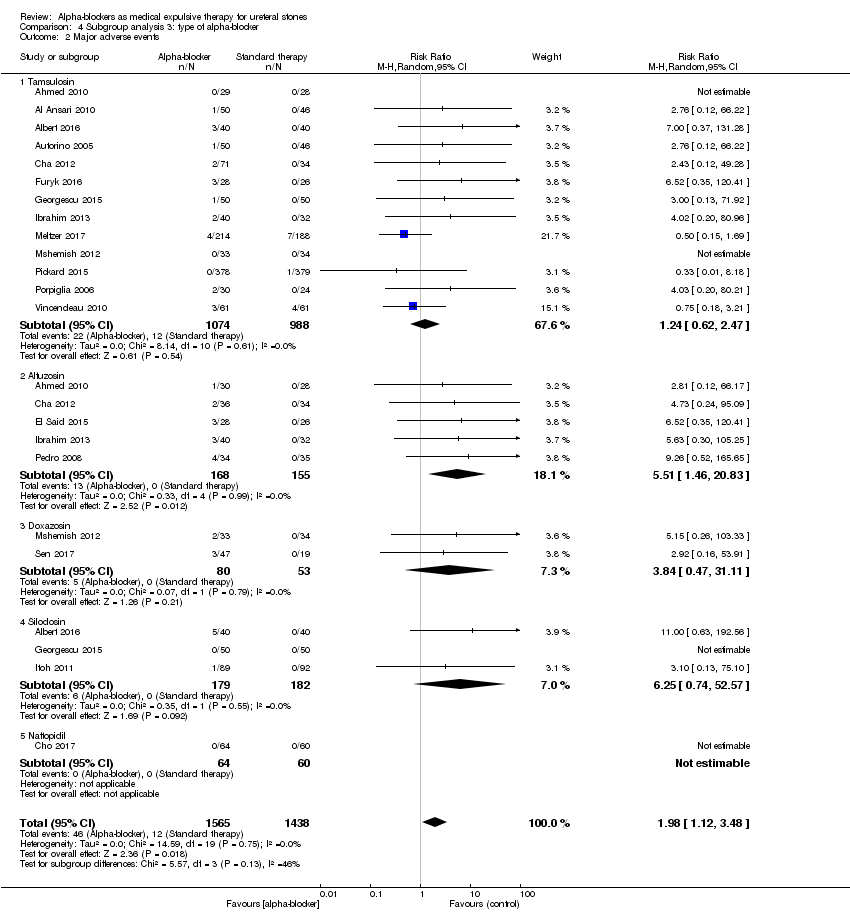
Comparison 4 Subgroup analysis 3: type of alpha‐blocker, Outcome 2 Major adverse events.

Comparison 4 Subgroup analysis 3: type of alpha‐blocker, Outcome 3 Stone expulsion time.

Comparison 4 Subgroup analysis 3: type of alpha‐blocker, Outcome 4 Pain episodes.
![Comparison 4 Subgroup analysis 3: type of alpha‐blocker, Outcome 5 Dose of diclofenac [mg].](/cdsr/doi/10.1002/14651858.CD008509.pub3/media/CDSR/CD008509/image_n/nCD008509-CMP-004-05.png)
Comparison 4 Subgroup analysis 3: type of alpha‐blocker, Outcome 5 Dose of diclofenac [mg].

Comparison 4 Subgroup analysis 3: type of alpha‐blocker, Outcome 6 Hospitalisation.

Comparison 4 Subgroup analysis 3: type of alpha‐blocker, Outcome 7 Surgical intervention.

Comparison 5 Sensitivity analysis 1: alpha‐blocker versus placebo, Outcome 1 Stone clearance.
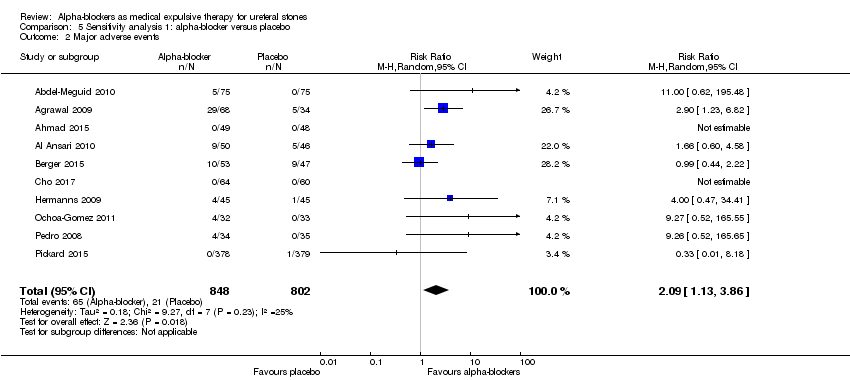
Comparison 5 Sensitivity analysis 1: alpha‐blocker versus placebo, Outcome 2 Major adverse events.
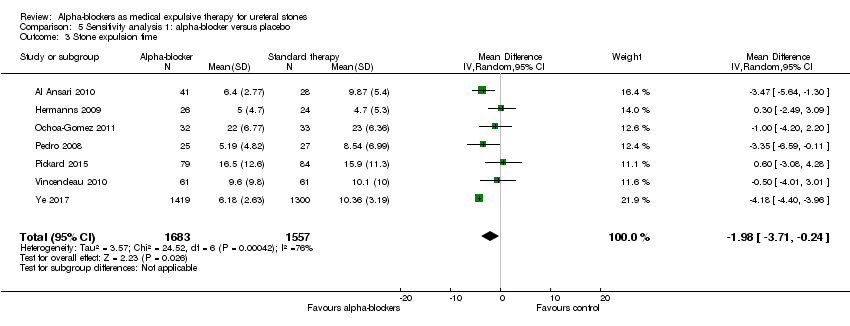
Comparison 5 Sensitivity analysis 1: alpha‐blocker versus placebo, Outcome 3 Stone expulsion time.
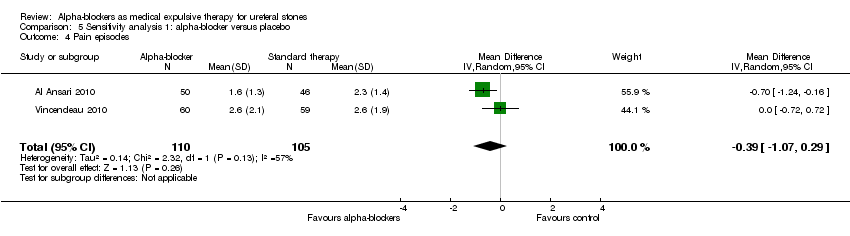
Comparison 5 Sensitivity analysis 1: alpha‐blocker versus placebo, Outcome 4 Pain episodes.
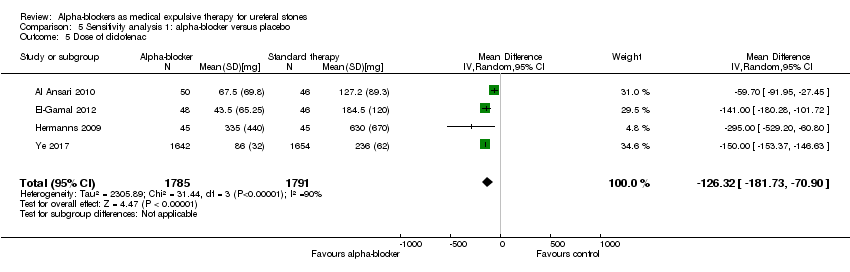
Comparison 5 Sensitivity analysis 1: alpha‐blocker versus placebo, Outcome 5 Dose of diclofenac.

Comparison 5 Sensitivity analysis 1: alpha‐blocker versus placebo, Outcome 6 Hospitalisation.
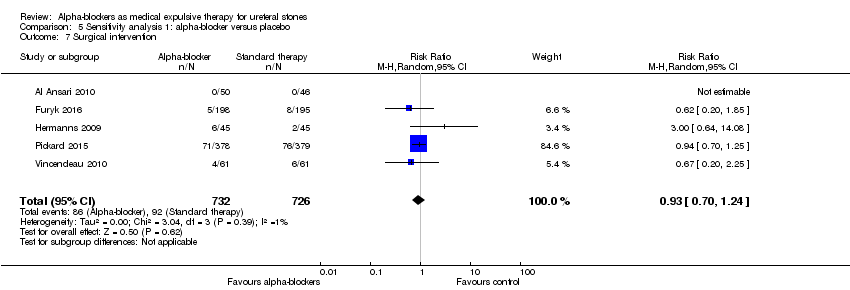
Comparison 5 Sensitivity analysis 1: alpha‐blocker versus placebo, Outcome 7 Surgical intervention.

Comparison 6 Sensitivity analysis 2: high‐quality studies, Outcome 1 Stone clearance.

Comparison 6 Sensitivity analysis 2: high‐quality studies, Outcome 2 Major adverse events.
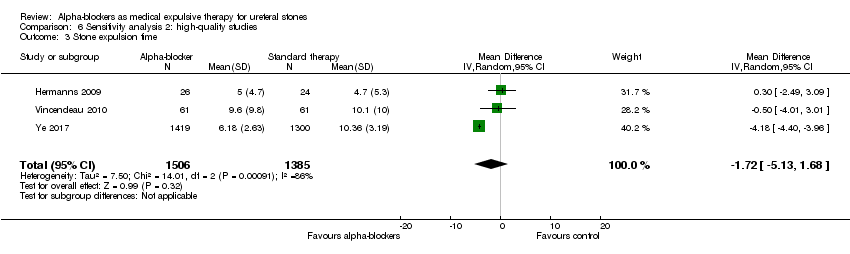
Comparison 6 Sensitivity analysis 2: high‐quality studies, Outcome 3 Stone expulsion time.

Comparison 6 Sensitivity analysis 2: high‐quality studies, Outcome 4 Pain episodes.

Comparison 6 Sensitivity analysis 2: high‐quality studies, Outcome 5 Dose of diclofenac.

Comparison 6 Sensitivity analysis 2: high‐quality studies, Outcome 6 Hospitalisation.
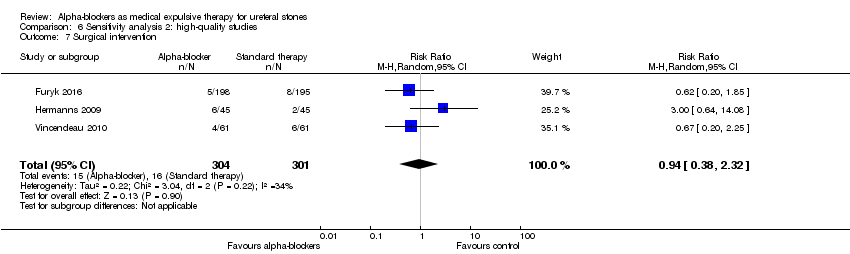
Comparison 6 Sensitivity analysis 2: high‐quality studies, Outcome 7 Surgical intervention.
| Alpha‐blockers compared with standard therapy for ureteral stones | |||||
| Patient or population: adult patients presenting with symptoms of ureteral stone disease Setting: single or multicenter Intervention: alpha‐blocker Comparison: standard therapy | |||||
| Outcomes | No. of participants | Quality of the evidence | Relative effect | Anticipated absolute effects* (95% CI) | |
| Risk with standard therapy | Risk difference with alpha‐blockers | ||||
| Stone clearance | 10509 | ⊕⊕⊝⊝ | RR 1.45 | Study population | |
| 619 per 1000 | 278 more per 1000 | ||||
| Major adverse events | 3124 | ⊕⊕⊝⊝ | RR 1.25 | Study population | |
| 20 per 1000 | 5 more per 1000 | ||||
| Stone expulsion time | 6031 | ⊕⊕⊝⊝ | ‐ | MD 3.4 lower | |
| Pain episodes | 1363 | ⊕⊕⊝⊝ | ‐ | MD 0.66 lower | |
| Dose of diclofenac | 4373 | ⊕⊕⊝⊝ | ‐ | MD 82.41 mg lower | |
| Hospitalisation | 1876 | ⊕⊕⊕⊝ | RR 0.51 | Study population | |
| 141 per 1000 | 69 fewer per 1000 | ||||
| Surgical intervention | 3292 | ⊕⊕⊝⊝ | RR 0.74 | Study population | |
| 109 per 1000 | 28 fewer per 1000 | ||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence. | |||||
| aMost studies were rated as having high or unclear risk of bias. bClinically important heterogeneity with I² of 76%; provided rationale for downgrading together with suspected publication bias. cPublication bias suspected given funnel plot asymmetry. dConfidence interval consistent; no effect and clinically important harm. eClinically important heterogeneity with I² of 94%; provided rationale for downgrading together with suspected publication bias. fClinically important heterogeneity with I² of 80%; provided rationale for downgrading together with suspected publication bias. gClinically important heterogeneity with I² of 100%; provided rationale for downgrading together with suspected publication bias. | |||||
| Alpha‐blockers compared with placebo for ureteral stones | |||||
| Patient or population: adult patients presenting with symptoms of ureteral stone disease Setting: single or multicenter Intervention: alpha‐blocker Comparison: placebo | |||||
| Outcomes | No. of participants | Quality of the evidence | Relative effect | Anticipated absolute effects* (95% CI) | |
| Risk with placebo | Risk difference with alpha‐blockers | ||||
| Stone clearance | 5787 | ⊕⊕⊕⊝ | RR 1.16 | Study population | |
| 728 per 1000 | 116 more per 1000 | ||||
| Major adverse events | 1650 | ⊕⊕⊕⊝ | RR 2.09 | Study population | |
| 26 per 1000 | 29 more per 1000 | ||||
| Stone expulsion time | 3240 | ⊕⊕⊝⊝ | ‐ | MD 1.98 lower | |
| Pain episodes | 215 | ⊕⊕⊝⊝ | ‐ | MD 0.39 lower | |
| Dose of diclofenac (mg) | 3576 | ⊕⊕⊝⊝ | ‐ | MD 126.32 lower | |
| Hospitalisation | 500 | ⊕⊕⊕⊝ | RR 0.84 | Study population | |
| 96 per 1000 | 15 fewer per 1000 | ||||
| Surgical intervention | 1458 | ⊕⊕⊕⊕ | RR 0.93 | Study population | |
| 127 per 1000 | 9 fewer per 1000 | ||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence. | |||||
| aDowngraded owing to inconsistency (high heterogeneity with I² of 68%). bDowngraded owing to imprecision (wide confidence interval consistent with negligible to substantial harm). cDowngraded owing to inconsistency (heterogeneity with I² of 57%). dDowngraded owing to imprecision (wide confidence interval; wide confidence interval consistent with large to negligible benefit). eDowngraded owing to imprecision (wide confidence interval consistent with no effect and small benefit). fDowngraded owing to inconsistency (high heterogeneity with I² of 90%). | |||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Stone clearance Show forest plot | 67 | 10509 | Risk Ratio (M‐H, Random, 95% CI) | 1.45 [1.36, 1.55] |
| 2 Major adverse events Show forest plot | 18 | 3124 | Risk Ratio (M‐H, Random, 95% CI) | 1.25 [0.80, 1.96] |
| 3 Stone expulsion time Show forest plot | 37 | 6031 | Mean Difference (IV, Random, 95% CI) | ‐3.40 [‐4.17, ‐2.63] |
| 4 Pain episodes Show forest plot | 15 | 1363 | Mean Difference (IV, Random, 95% CI) | ‐0.66 [‐0.91, ‐0.42] |
| 5 Dose of diclofenac Show forest plot | 14 | 4373 | Mean Difference (IV, Random, 95% CI) | ‐82.41 [‐122.51, ‐42.31] |
| 6 Hospitalisation Show forest plot | 13 | 1876 | Risk Ratio (M‐H, Random, 95% CI) | 0.51 [0.34, 0.77] |
| 7 Surgical intervention Show forest plot | 19 | 3292 | Risk Ratio (M‐H, Random, 95% CI) | 0.74 [0.53, 1.02] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Stone clearance Show forest plot | 16 | 5509 | Risk Ratio (M‐H, Random, 95% CI) | 1.17 [1.08, 1.27] |
| 1.1 Stone size ≤ 5 mm | 14 | 2622 | Risk Ratio (M‐H, Random, 95% CI) | 1.06 [0.98, 1.15] |
| 1.2 Stone size 6‐10 mm | 10 | 2887 | Risk Ratio (M‐H, Random, 95% CI) | 1.45 [1.22, 1.72] |
| 2 Stone expulsion time Show forest plot | 6 | 3148 | Mean Difference (IV, Random, 95% CI) | ‐3.39 [‐5.82, ‐0.97] |
| 2.1 Stone size ≤ 5 mm | 6 | 1264 | Mean Difference (IV, Random, 95% CI) | ‐1.07 [‐1.99, ‐0.15] |
| 2.2 Stone size 6‐10 mm | 4 | 1884 | Mean Difference (IV, Random, 95% CI) | ‐5.99 [‐7.16, ‐4.82] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Stone clearance Show forest plot | 60 | 9370 | Risk Ratio (M‐H, Random, 95% CI) | 1.44 [1.34, 1.54] |
| 1.1 Distal ureter | 57 | 8576 | Risk Ratio (M‐H, Random, 95% CI) | 1.46 [1.36, 1.57] |
| 1.2 Mid or proximal ureter | 9 | 794 | Risk Ratio (M‐H, Random, 95% CI) | 1.28 [0.99, 1.66] |
| 2 Stone expulsion time Show forest plot | 32 | 5599 | Mean Difference (IV, Random, 95% CI) | ‐3.67 [‐4.50, ‐2.85] |
| 2.1 Distal ureter | 32 | 5453 | Mean Difference (IV, Random, 95% CI) | ‐3.43 [‐4.26, ‐2.60] |
| 2.2 Mid or proximal ureter | 2 | 146 | Mean Difference (IV, Random, 95% CI) | ‐8.64 [‐19.75, 2.48] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Stone clearance Show forest plot | 67 | 10897 | Risk Ratio (M‐H, Random, 95% CI) | 1.49 [1.39, 1.58] |
| 1.1 Tamsulosin | 54 | 8896 | Risk Ratio (M‐H, Random, 95% CI) | 1.47 [1.37, 1.59] |
| 1.2 Alfuzosin | 6 | 391 | Risk Ratio (M‐H, Random, 95% CI) | 1.51 [1.14, 2.01] |
| 1.3 Doxazosin | 7 | 441 | Risk Ratio (M‐H, Random, 95% CI) | 1.49 [1.29, 1.72] |
| 1.4 Terazosin | 2 | 119 | Risk Ratio (M‐H, Random, 95% CI) | 1.44 [1.10, 1.89] |
| 1.5 Naftopidil | 3 | 270 | Risk Ratio (M‐H, Random, 95% CI) | 2.02 [1.01, 4.03] |
| 1.6 Silodosin | 6 | 780 | Risk Ratio (M‐H, Random, 95% CI) | 1.39 [1.20, 1.61] |
| 2 Major adverse events Show forest plot | 18 | 3003 | Risk Ratio (M‐H, Random, 95% CI) | 1.98 [1.12, 3.48] |
| 2.1 Tamsulosin | 13 | 2062 | Risk Ratio (M‐H, Random, 95% CI) | 1.24 [0.62, 2.47] |
| 2.2 Alfuzosin | 5 | 323 | Risk Ratio (M‐H, Random, 95% CI) | 5.51 [1.46, 20.83] |
| 2.3 Doxazosin | 2 | 133 | Risk Ratio (M‐H, Random, 95% CI) | 3.84 [0.47, 31.11] |
| 2.4 Silodosin | 3 | 361 | Risk Ratio (M‐H, Random, 95% CI) | 6.25 [0.74, 52.57] |
| 2.5 Naftopidil | 1 | 124 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 3 Stone expulsion time Show forest plot | 35 | 6212 | Mean Difference (IV, Random, 95% CI) | ‐3.56 [‐4.25, ‐2.87] |
| 3.1 Tamsulosin | 30 | 5052 | Mean Difference (IV, Random, 95% CI) | ‐3.07 [‐4.04, ‐2.09] |
| 3.2 Alfuzosin | 3 | 180 | Mean Difference (IV, Random, 95% CI) | ‐4.75 [‐6.63, ‐2.88] |
| 3.3 Doxazosin | 4 | 263 | Mean Difference (IV, Random, 95% CI) | ‐4.73 [‐6.15, ‐3.32] |
| 3.4 Terazosin | 2 | 119 | Mean Difference (IV, Random, 95% CI) | ‐4.42 [‐5.36, ‐3.48] |
| 3.5 Naftopidil | 1 | 86 | Mean Difference (IV, Random, 95% CI) | ‐1.80 [‐2.80, ‐0.80] |
| 3.6 Silodosin | 4 | 512 | Mean Difference (IV, Random, 95% CI) | ‐4.98 [‐6.43, ‐3.52] |
| 4 Pain episodes Show forest plot | 15 | 1595 | Mean Difference (IV, Random, 95% CI) | ‐0.71 [‐0.89, ‐0.52] |
| 4.1 Tamsulosin | 13 | 992 | Mean Difference (IV, Random, 95% CI) | ‐0.69 [‐0.98, ‐0.41] |
| 4.2 Alfuzosin | 1 | 58 | Mean Difference (IV, Random, 95% CI) | ‐0.32 [‐0.82, 0.18] |
| 4.3 Doxazosin | 3 | 190 | Mean Difference (IV, Random, 95% CI) | ‐0.76 [‐0.92, ‐0.60] |
| 4.4 Terazosin | 2 | 119 | Mean Difference (IV, Random, 95% CI) | ‐0.67 [‐1.16, ‐0.17] |
| 4.5 Naftopidil | 1 | 86 | Mean Difference (IV, Random, 95% CI) | ‐0.80 [‐1.23, ‐0.37] |
| 4.6 Silodosin | 2 | 150 | Mean Difference (IV, Random, 95% CI) | ‐0.89 [‐2.05, 0.26] |
| 5 Dose of diclofenac [mg] Show forest plot | 14 | 4429 | Mean Difference (IV, Random, 95% CI) | ‐78.11 [‐113.25, ‐42.97] |
| 5.1 Tamsulosin | 12 | 4135 | Mean Difference (IV, Random, 95% CI) | ‐87.60 [‐131.98, ‐43.21] |
| 5.2 Doxazosin | 1 | 57 | Mean Difference (IV, Random, 95% CI) | ‐63.46 [‐72.88, ‐54.04] |
| 5.3 Terazosin | 1 | 56 | Mean Difference (IV, Random, 95% CI) | ‐64.29 [‐74.17, ‐54.41] |
| 5.4 Silodosin | 2 | 181 | Mean Difference (IV, Random, 95% CI) | ‐54.72 [‐89.91, ‐19.53] |
| 6 Hospitalisation Show forest plot | 13 | 2028 | Risk Ratio (M‐H, Random, 95% CI) | 0.44 [0.29, 0.66] |
| 6.1 Tamsulosin | 11 | 1606 | Risk Ratio (M‐H, Random, 95% CI) | 0.57 [0.38, 0.86] |
| 6.2 Alfuzosin | 2 | 110 | Risk Ratio (M‐H, Random, 95% CI) | 0.35 [0.09, 1.45] |
| 6.3 Doxazosin | 2 | 132 | Risk Ratio (M‐H, Random, 95% CI) | 0.19 [0.01, 3.05] |
| 6.4 Silodosin | 2 | 180 | Risk Ratio (M‐H, Random, 95% CI) | 0.26 [0.12, 0.55] |
| 7 Surgical intervention Show forest plot | 19 | 3404 | Risk Ratio (M‐H, Random, 95% CI) | 0.74 [0.55, 0.99] |
| 7.1 Tamsulosin | 16 | 2820 | Risk Ratio (M‐H, Random, 95% CI) | 0.82 [0.59, 1.13] |
| 7.2 Alfuzosin | 1 | 58 | Risk Ratio (M‐H, Random, 95% CI) | 0.47 [0.09, 2.35] |
| 7.3 Doxazosin | 2 | 133 | Risk Ratio (M‐H, Random, 95% CI) | 0.41 [0.15, 1.11] |
| 7.4 Silodosin | 3 | 393 | Risk Ratio (M‐H, Random, 95% CI) | 0.29 [0.06, 1.31] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Stone clearance Show forest plot | 15 | 5787 | Risk Ratio (M‐H, Random, 95% CI) | 1.16 [1.07, 1.25] |
| 2 Major adverse events Show forest plot | 10 | 1650 | Risk Ratio (M‐H, Random, 95% CI) | 2.09 [1.13, 3.86] |
| 3 Stone expulsion time Show forest plot | 7 | 3240 | Mean Difference (IV, Random, 95% CI) | ‐1.98 [‐3.71, ‐0.24] |
| 4 Pain episodes Show forest plot | 2 | 215 | Mean Difference (IV, Random, 95% CI) | ‐0.39 [‐1.07, 0.29] |
| 5 Dose of diclofenac Show forest plot | 4 | 3576 | Mean Difference (IV, Random, 95% CI) | ‐126.32 [‐181.73, ‐70.90] |
| 6 Hospitalisation Show forest plot | 2 | 500 | Risk Ratio (M‐H, Random, 95% CI) | 0.84 [0.48, 1.47] |
| 7 Surgical intervention Show forest plot | 5 | 1458 | Risk Ratio (M‐H, Random, 95% CI) | 0.93 [0.70, 1.24] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Stone clearance Show forest plot | 5 | 4133 | Risk Ratio (M‐H, Random, 95% CI) | 1.09 [1.06, 1.13] |
| 2 Major adverse events Show forest plot | 2 | 515 | Risk Ratio (M‐H, Random, 95% CI) | 0.94 [0.51, 1.72] |
| 3 Stone expulsion time Show forest plot | 3 | 2891 | Mean Difference (IV, Random, 95% CI) | ‐1.72 [‐5.13, 1.68] |
| 4 Pain episodes Show forest plot | 1 | 119 | Mean Difference (IV, Random, 95% CI) | 0.0 [‐0.72, 0.72] |
| 5 Dose of diclofenac Show forest plot | 2 | 3386 | Mean Difference (IV, Random, 95% CI) | ‐173.28 [‐277.60, ‐68.95] |
| 6 Hospitalisation Show forest plot | 1 | 403 | Risk Ratio (M‐H, Random, 95% CI) | 0.87 [0.49, 1.52] |
| 7 Surgical intervention Show forest plot | 3 | 605 | Risk Ratio (M‐H, Random, 95% CI) | 0.94 [0.38, 2.32] |