Diferentes duraciones del tratamiento con corticosteroides para las exacerbaciones de la enfermedad pulmonar obstructiva crónica
Resumen
Antecedentes
Las guías actuales recomiendan que los pacientes con exacerbaciones agudas de la enfermedad pulmonar obstructiva crónica (EPOC) sean tratados con corticosteroides sistémicos entre siete y 14 días. La administración intermitente de corticosteroides sistémicos se asocia de manera acumulativa con efectos adversos como osteoporosis, hiperglucemia y debilidad muscular. Un tratamiento más corto podría reducir los efectos adversos.
Objetivos
Comparar la eficacia del tratamiento con corticosteroides sistémicos de corta duración (siete días o menos) versus tratamiento convencional de duración más larga (más de siete días) en adultos con exacerbaciones agudas de la EPOC.
Métodos de búsqueda
Las búsquedas se realizaron utilizando el registro especializado de ensayos del Grupo Cochrane de Vías Respiratorias (Cochrane Airways Group), MEDLINE y CENTRAL (Cochrane Central Register of Controlled Trials) hasta junio 2014 y en registros de ensayos en curso hasta julio 2014.
Criterios de selección
Ensayos controlados aleatorios que compararan diferentes duraciones del tratamiento con corticosteroides sistémicos definido como corto (es decir, siete días o menos) o más largo (es decir, más de siete días). Se estandarizaron otras intervenciones (broncodilatadores y antibióticos). Se excluyeron los estudios con participantes que requerían asistencia respiratoria.
Obtención y análisis de los datos
Se utilizaron los procedimientos metodológicos estándar previstos por La Colaboración Cochrane.
Resultados principales
Ocho estudios con 582 participantes cumplieron los criterios de inclusión, de los cuales cinco estudios realizados en hospitales con 519 participantes (rango 28 a 296) contribuyeron al metanálisis. La media de edad de los participantes de los estudios fue de 65 a 73 años, varió la proporción de participantes masculinos (58% a 84%) y la EPOC se clasificó como grave o muy grave. El tratamiento con corticosteroides se administró en dosis diarias equivalentes entre tres y siete días para el tratamiento de corta duración y entre 10 y 15 días para el tratamiento de duración más larga. Cinco estudios administraron prednisolona oral (30 mg en cuatro, en dosis decrecientes en uno), y dos estudios proporcionaron tratamiento con corticosteroides intravenosos. Los estudios que aportaron datos al metanálisis estuvieron en riesgo bajo de sesgo de selección, realización, detección y deserción. En cuatro estudios no se encontró una diferencia en el riesgo de fracaso del tratamiento entre el tratamiento con corticosteroides sistémicos de corta duración y de duración más larga (n = 457; odds ratio [OR] 0,72; intervalo de confianza [IC] del 95%: 0,36 a 1,46), que fue equivalente a 22 menos por 1000 para el tratamiento de corta duración (IC del 95%: 51 menos a 34 más). No se observó ninguna diferencia en el riesgo de recaída (un nuevo evento) entre el tratamiento con corticosteroides sistémicos de corta duración y el de duración más larga (n = 457; OR 1,04; IC del 95%: 0,70 a 1,56), que fue equivalente a nueve menos por 1000 durante el tratamiento de corta duración (IC del 95%: 68 menos a 100 más). El tiempo hasta la próxima exacerbación de la EPOC no difirió en un estudio amplio con la potencia estadística suficiente para detectar la "no inferioridad" y comparó cinco días versus 14 días de tratamiento con corticosteroides sistémicos (n = 311; cociente de riesgos instantáneos 0,95; IC del 95%: 0,66 a 1,37). En cinco estudios no se encontró ninguna diferencia en la probabilidad de un evento adverso entre el tratamiento con corticosteroides sistémicos de corta duración y el de duración más larga (n = 503; OR 0,89; IC del 95%: 0,46 a 1,69; o nueve menos por 1000 [IC del 95%: 44 menos a 51 más]). La duración de la estancia hospitalaria (n = 421; diferencia de medias [DM] ‐0,61 días, IC del 95%: ‐1,51 a 0,28) y la función pulmonar al final del tratamiento (n = 185; DM VEF1 a 0,04 L; IC del 95%: ‐0,19 a 0,10) no difirieron entre el tratamiento de corta duración y el de duración más larga.
Conclusiones de los autores
La información de un nuevo estudio amplio ha aumentado la confianza en la probabilidad de que cinco días de corticosteroides orales sean suficientes para el tratamiento en adultos con exacerbaciones agudas de la EPOC, y esta revisión sugiere una probabilidad baja de que los ciclos más cortos de corticosteroides sistémicos (de alrededor de cinco días) den lugar a resultados peores que los observados con los ciclos más largos (10 a 14 días). La calidad de la mayoría de las pruebas disponibles se consideró moderada debido a la imprecisión; es probable que los futuros trabajos de investigación tengan una marcada repercusión sobre la confianza en la estimación del efecto o puedan cambiar los cálculos. Los estudios de esta revisión no incluían a pacientes con EPOC leve o moderada; se necesitan estudios adicionales que comparen el tratamiento con corticosteroides sistémicos de corta duración versus tratamiento convencional con corticosteroides sistémicos de duración más larga para los adultos con exacerbaciones agudas de la EPOC.
PICOs
Resumen en términos sencillos
¿Los ciclos más cortos de corticosteroides sistémicos presentan la misma efectividad que los ciclos convencionales más largos en el tratamiento de los pacientes con exacerbaciones de la EPOC?
¿Por qué es importante esta pregunta?
La enfermedad pulmonar obstructiva crónica (EPOC), que incluye enfisema y bronquitis crónica, es un trastorno pulmonar a largo plazo que comúnmente se asocia con el hábito de fumar. Los pacientes con EPOC pueden experimentar exacerbaciones, a menudo precipitadas por la infección, en las cuales los síntomas como la disnea, la tos y la flema empeoran de forma marcada, y se necesita tratamiento extra o el ingreso al hospital.
Los corticosteroides sistémicos (es decir no inhalados), como la prednisolona, la prednisona y la cortisona, se usan comúnmente en el tratamiento de los pacientes con estas exacerbaciones. Se deseaba evaluar si un ciclo más corto (siete días o menos) de este tratamiento era igual de efectivo que un ciclo con la duración habitual (más de siete días) y causaba menos efectos secundarios.
¿Cómo se respondió a la pregunta?
Se realizaron búsquedas de todos los estudios que comparaban el tratamiento con corticosteroides orales o inyectados, administrados durante siete días o menos, versus el tratamiento administrado durante más de siete días en los pacientes con exacerbaciones agudas de la EPOC.
¿Qué se encontró?
Se encontraron ocho estudios que incluían a 582 pacientes con EPOC que experimentaron una exacerbación que requirió tratamiento extra en el hospital. Estos estudios compararon el tratamiento con corticosteroides orales o inyectados administrados durante siete días o menos versus tratamiento durante más de siete días. La mayoría de los pacientes de estos estudios tenían más de sesenta años de edad y presentaban síntomas graves o muy graves de la EPOC; participaron más pacientes hombres que mujeres. Se llevó a cabo la última búsqueda de estudios para ser incluidos en la revisión en junio de 2014.
No se observó ninguna diferencia entre los tratamientos más cortos y más largos. Los pacientes tratados durante siete días o menos no presentaron una tasa mayor de fracaso del tratamiento ni un tiempo más largo hasta la próxima exacerbación; el número de pacientes que evitaron el fracaso del tratamiento varió de 51 menos a 34 más por 1000 tratados (promedio 22 pacientes menos por 1000). El tiempo en el hospital y la función pulmonar (pruebas que incluyen soplar aire) al final del tratamiento no fueron diferentes. No se observaron diferencias en los efectos secundarios o muerte entre los tratamientos. La información sobre la calidad de vida, que es un resultado importante para los pacientes con EPOC, es limitada, debido a que sólo un estudio midió este resultado.
Los ocho estudios incluidos en esta revisión fueron generalmente bien diseñados, y la calidad de las pruebas fue calificada como moderada debido a la imprecisión en los resultados; se necesita más investigación, especialmente en pacientes con EPOC menos grave.
Conclusiones de los autores
Summary of findings
| SCS treatment for 7 or fewer days compared with SCS treatment for longer than 7 days for acute exacerbations of COPD | ||||||
| Patient or population: patients with acute exacerbations of COPD | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| SCS treatment for longer than 7 days | SCS treatment for 7 or fewer days | |||||
| Treatment failure | 83 per 1000 | 61 per 1000 | OR 0.72 | 457 | ⊕⊕⊕⊝ | Equivalent to 22 fewer (95% CI 51 fewer to 34 more) |
| Relapse | 295 per 1000 | 304 per 1000 | OR 1.04 | 478 | ⊕⊕⊕⊝ | In one study (Leuppi 2013), hazard ratio for time to re‐exacerbation was 0.95 (95% CI 0.66 to 1.37) |
| Adverse drug effect—hyperglycaemia | 442 per 1000 | 439 per 1000 | OR 0.99 | 345 | ⊕⊕⊕⊝ | |
| Adverse drug effects | 84 per 1000 | 75 per 1000 | OR 0.88 | 503 | ⊕⊕⊝⊝ | |
| Mortality | 77 per 1000 | 71 per 1000 | OR 0.91 | 336 | ⊕⊕⊕⊝ | |
| Length of hospitalisation | Mean length of hospitalisation in control groups was | Mean length of hospitalisation in intervention groups was | 421 | ⊕⊕⊕⊝ | ||
| Lung function (end of treatment) | Mean FEV1 in control groups ranged from 0.84 to 1.14 L | Mean lung function (end of treatment) in intervention groups was | 187 | ⊕⊝⊝⊝ | ||
| Health‐related quality of life (QOL) Overall score (includes activity limitations, symptoms, fatigue, emotional functioning); scale 0 best to 6 worst; minimum important difference 0.5 Follow‐up: 30 days | Mean QOL score in control groups was 1.24 | Mean QOL score in intervention groups was 0.06 higher (‐0.16 lower to 0.28 higher) | 271 (1 study) | ⊕⊕⊕⊝ | ||
| *The basis for the assumed risk (e.g. median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aWide confidence intervals include significant benefit or harm (‐1 for imprecision). | ||||||
Antecedentes
Descripción de la afección
La enfermedad pulmonar obstructiva crónica (EPOC) se caracteriza por la limitación persistente del flujo respiratorio que generalmente es progresiva y se asocia con una respuesta inflamatoria crónica a partículas o gases nocivos en las vías respiratorias y los pulmones (GOLD 2014). Un diagnóstico de EPOC se considera sobre una base clínica ante la presencia de síntomas como disnea, tos crónica o producción de esputo y exposición a factores de riesgo conocidos. La confirmación del diagnóstico de EPOC se basa en la demostración de una limitación persistente del flujo respiratorio con espirometría, de acuerdo al criterio del volumen espiratorio forzado en un segundo (VEF1)/capacidad vital forzada (CVF) posbroncodilatador menor que 0,7; según se especifica en las guías incluidas en el GOLD (Global Strategy for Diagnosis, Management, and Prevention of COPD) (GOLD 2014). Sin embargo, cada vez se reconoce más la heterogeneidad (Agusti 2010) y la variación fenotípica en la EPOC (Weatherall 2009). Se sabe que la EPOC y el síndrome superpuesto de asma tienen una prevalencia mayor en individuos mayores y se asocian con exacerbaciones más frecuentes (Hardin 2014).
La EPOC es una causa importante y cada vez mayor de mortalidad; se calculó que fue la quinta causa principal de muerte en el año 2000 y que fue responsable de 2 750 000 de muertes (Lopez 2006). Se proyecta que la mortalidad global debido a la EPOC se elevará a 4 500 000 muertes en 2020, convirtiéndose en la tercera causa principal (Murray 1997). La EPOC a nivel mundial dio lugar a 16 500 000 años de vida perdidos en 2000; casi 10 000 000 años de vida con discapacidad y 26 500 000 años de vida ajustados en función a la discapacidad (Lopez 2006).
El estudio Burden of Lung Disease (BOLD) (Buist 2007) informó una prevalencia global de estadio II o mayor gravedad (VEF1 < 80% teórico) del 10,1% (error estándar [EE] 4,8) en general, 11,8% (EE 7,9) para los hombres y 8,5% (EE 5,8) para las mujeres. La variación internacional en la prevalencia y gravedad de la EPOC es explicada parcialmente por la variación en la prevalencia del hábito de fumar y otros factores de riesgo (Buist 2007 ).
Las exacerbaciones y la comorbilidad contribuyen a la evolución natural variable de la EPOC en los pacientes individuales (GOLD 2014). Las exacerbaciones contribuyen a la disminución a largo plazo en la función pulmonar (Donaldson 2002) y a la reducción de la actividad física (Donaldson 2005 ) y se asocian con un mayor riesgo de muerte (Soler‐Cataluna 2005). Además, tienen un efecto profundo y de larga duración sobre la calidad de vida (Groenewegen 2001; Wilkinson 2004); en un 10% de las exacerbaciones, la calidad de vida previa a la exacerbación no se recuperó después de tres meses (Seemungal 2000).
Las exacerbaciones de la EPOC son una causa frecuente de hospitalización (Donaldson 2006), aunque las exacerbaciones con síntomas y signos menos graves a menudo se tratan de forma ambulatoria (NICE 2010). Los servicios de hospital domiciliario o de alta temprana, si están disponibles, pueden usarse como una forma alternativa de atención para los pacientes con exacerbaciones de la EPOC que de otro modo necesitarían ingresar o permanecer en el hospital (NICE 2010). El tratamiento de los pacientes con exacerbaciones contribuye ampliamente a la carga económica de la EPOC (Schermer 2002; Sullivan 2000), y una proporción alta de los costos se debe a la hospitalización (Oostenbrink 2004).
Los estudios sobre la frecuencia de las exacerbaciones usan generalmente una definición "basada en el evento" sobre la base de la utilización de asistencia sanitaria (Effing 2009), y varios eventos diferentes pueden ser un sustituto de la gravedad; las visitas al consultorio o a la sala de urgencias no programadas dan lugar a una calificación "moderada" y la necesidad de hospitalización se denomina "grave" (Rodriguez‐Roisin 2000). Sin embargo, la aparición clínica de una exacerbación aguda se define de acuerdo a los síntomas, aunque se desconoce una definición universalmente aceptada (Rodriguez‐Roisin 2000). Las exacerbaciones de tipo 1 fueron definidas originalmente por Anthonisen sobre la base de tres síntomas principales: aumento en la disnea, volumen de esputo y purulencia del esputo; las exacerbaciones de tipo 2 se asociaron solamente con dos de los síntomas principales, y las exacerbaciones de tipo 3 incluyeron un síntoma principal más tos, sibilancias o síntomas de una infección de las vías respiratorias superiores (Anthonisen 1987). Una definición posterior requería un aumento de dos de los "síntomas principales" de la disnea—volumen de esputo o purulencia del esputo—o en un síntoma principal y un "síntoma menor" (sibilancias, dolor de garganta, tos o síntomas de resfriado común) durante dos días (Seemungal 2000). Más recientemente, se ha desarrollado una medida estandarizada para evaluar la frecuencia, la gravedad y la duración de las exacerbaciones de la EPOC mediante resultados informados por los pacientes para el uso en los estudios clínicos: el diario EXACT (exacerbations of chronic pulmonary disease tool), que consta de 14 ítems (Leidy 2010; Leidy 2011).
Los mecanismos inflamatorios que son la base de la aparición y el desarrollo de las exacerbaciones de la EPOC son complejos (Bathoorn 2008); las exacerbaciones pueden ser precipitadas por varios factores, y las causas más frecuentes son las bacterias patógenas infectivas (Papi 2006); identificadas en poco más del 50% de los casos, y causas virales en alrededor del 25% (Sethi 2002; Sherk 2000). Las causas no infectivas como la contaminación del aire y otras condiciones ambientales que aumentan la inflamación de las vías respiratorias pueden representar un 15% a un 20% de las exacerbaciones (Sethi 2008). Las exacerbaciones se vuelven más frecuentes y más graves a medida que la gravedad de la EPOC aumenta (Suissa 2012), aunque la tasa a la que ocurren puede reflejar un fenotipo de sensibilidad independiente—"causa de exacerbación frecuente" (Hurst 2010).
Descripción de la intervención
La respuesta inflamatoria aguda a la infección de las vías respiratorias es influenciada por factores tanto patógenos como del huésped, lo cual da lugar a una mayor inflamación de las vías respiratorias y sistémicas (Sethi 2008). La inflamación de las vías respiratorias aumenta significativamente durante las exacerbaciones de la EPOC, y se observan pruebas de un mayor número de neutrófilos, linfocitos y eosinófilos en las vías respiratorias y en el esputo (Falk 2008; Papi 2006). La inflamación sistémica también está presente en la EPOC; se elevan muchos mediadores inflamatorios circulantes, tanto en la EPOC estable como durante las exacerbaciones. La proteína C‐reactiva (PCR) es un marcador conocido de inflamación sistémica cuyos niveles se elevan durante las exacerbaciones; es un participante probable en la cascada inflamatoria (Falk 2008). Los mecanismos teóricos para la mejoría clínica en la función pulmonar entre los pacientes tratados con corticosteroides durante las exacerbaciones pueden incluir la reducción de la inflamación de las vías respiratorias o una disminución en el edema de las vías respiratorias (Wedzicha 2000).
Por qué es importante realizar esta revisión
El uso de corticosteroides sistémicos en la EPOC se asocia con efectos adversos potenciales del fármaco, que incluyen retención de líquido, hipertensión, diabetes mellitus, supresión suprarrenal y osteoporosis (McEvoy 1996). El riesgo de fracturas aumenta (De Vries 2007; Vestergaard 2007); lo cual es potencialmente importante debido a que la tasa de fracturas por compresión vertebral existentes en la población con EPOC que experimenta exacerbaciones agudas, especialmente entre los pacientes mayores con enfermedades de duración más larga, es alta (Majumdar 2010). El uso a corto plazo de corticosteroides sistémicos para el tratamiento de pacientes con exacerbaciones de la EPOC también produce efectos adversos en la fuerza de los músculos periféricos y respiratorios (Decramer 1994). El riesgo de efectos adversos de los corticosteroides sistémicos en la EPOC asciende con el aumento de la frecuencia del uso de corticosteroides sistémicos en dosis alta y con el aumento de la exposición acumulativa (más de 1 g) (De Vries 2007).
El tratamiento con corticosteroides sistémicos de los pacientes con exacerbaciones agudas de la EPOC reduce el fracaso del tratamiento y se asocia con una mejoría temprana en la función pulmonar, la disnea y la hipoxemia arterial y una reducción en la duración de la estancia hospitalaria (Walters 2014), aunque en esta revisión Cochrane, la duración del tratamiento con corticosteroides sistémicos varió, y generalmente se describió como de entre tres días y 15 días. Las guías para el tratamiento de la EPOC especifican una duración del tratamiento que varía desde siete días a diez días (GOLD 2014), desde siete días a 14 días (NICE 2010) y desde diez días a 14 días (McKenzie 2003). Por lo tanto, es importante definir la duración óptima del tratamiento con corticosteroides y tener en cuenta la posibilidad de limitar los efectos adversos potenciales.
Objetivos
Comparar la eficacia del tratamiento con corticosteroides sistémicos de corta duración (siete días o menos) versus tratamiento convencional de duración más larga (más de siete días) en adultos con exacerbaciones agudas de la EPOC.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Ensayos controlados aleatorios (ECA) que compararan el tratamiento con corticosteroides sistémicos de corta duración (siete días o menos) versus tratamiento convencional de duración más larga (más de siete días).
Tipos de participantes
Adultos con exacerbaciones agudas de la EPOC. La definición de las exacerbaciones agudas podía incluir una combinación de aumento en la disnea, el volumen del esputo, la purulencia del esputo, la tos o las sibilancias. Se excluyeron los estudios con pacientes con asma y otras enfermedades pulmonares (p.ej. neumopatía intersticial, bronquiectasia), a menos que se dispusiera de los datos individuales de los participantes con EPOC.
Tipos de intervenciones
Corticosteroides sistémicos administrados durante un período de siete días o menos (corticosteroides sistémicos ≤ 7) versus corticosteroides sistémicos administrados durante más de siete días (corticosteroides sistémicos > 7). Era necesario que las cointervenciones estuvieran estandarizadas entre los grupos. Se excluyeron los estudios en los cuales los participantes eran sometidos a asistencia respiratoria (invasiva o no invasiva).
Tipos de medida de resultado
Resultados primarios
-
Fracaso del tratamiento (p.ej. necesidad de tratamiento adicional, ingreso/reingreso al hospital por un episodio índice, regreso al servicio de urgencias o visita médica no programada por el episodio índice).
-
Recaída después del tratamiento (p.ej. tratamiento para la nueva exacerbación aguda, reingreso u hospitalización a causa de la EPOC).
-
Efectos adversos del fármaco.
Resultados secundarios
-
Mortalidad.
-
Función pulmonar.
-
Duración de la estancia hospitalaria.
-
Gases en sangre arterial.
-
Puntuaciones de los síntomas.
-
Calidad de vida.
Período de tiempo para la evaluación de los resultados continuos: La respuesta temprana se midió en o antes del día siete de tratamiento, y las mediciones de la respuesta al final del tratamiento se realizaron en el momento equivalente al final del período más largo de tratamiento.
Results
Description of studies
Results of the search
Of 644 unique records obtained in the 2011 searches (Figure 1), seven studies met the inclusion criteria, of which four reported data and contributed to the original meta‐analysis (Walters 2011). One ongoing study (Reid 2010) suspended recruitment in 2010, but no data are available. Searches from 2011 to 2014 yielded 284 results in the Cochrane Airways Group Register of Trials, 39 results in CINAHL, 168 in EMBASE and 102 in CENTRAL. When the inclusion criteria were applied, one new study was identified for inclusion (Leuppi 2013), which was listed as an ongoing trial in 2011. No new ongoing trials have been located as of 2014.

1 Study flow diagram.
Included studies
We have provided details of the eight included studies in the Characteristics of included studies table and a comparison of their main inclusion criteria and characteristics in Table 1.
| Study ID/Setting | Inclusion criteria | AE definition | N participants included/Completing | Mean age, years | % males/ % smokers | Prestudy SCS use, % | SCS ≤ 7 days | SCS > 7 days | Definition of treatment failure |
| Chen 2005 China/ inpatients | 2 years of continuous productive cough, FEV1/FVC post BD < 0.7, FEV1 < 80% predicted. No respiratory failure, diabetes or bronchial asthma | At least 2 of 3 symptoms: increased sputum or dyspnoea or purulent sputum | 86/81 | 71 | 75/44 | Not stated | Prednisolone 30 mg 7 days | Prednisolone 30 mg/d 10 days + 15 mg/d 5 days | Not known |
| Gomaa 2008 (abstract only) | FEV1 < 50% predicted, no respiratory acidosis | Not stated | 42/Not known | Not stated | Not stated | Not stated | Prednisolone 30 mg 7 days | Prednisolone 30 mg 15 days | Outcome not reported |
| Leuppi 2013 Switzerland/5 sites | Age > 40 years, smoking history ≥ 20 pack‐years | At least 2 of the following: change in baseline dyspnoea, cough or sputum quantity/purulence | 314/296 | 69 | 60/45 | 20 | 5 days: days 1 to 4 methylprednisolone 40 mg, days 2 to 5 oral prednisolone 40 mg | 14 days: days 1 to 4 methylprednisolone 40 mg, days 2 to 14 oral 40 mg prednisolone | Received open‐label glucocorticoids during index exacerbation |
| Rahman 2004 (abstract only) Bangladesh/1 site | Not stated | Not stated | Not stated | Not stated | Not stated | Not stated | Prednisolone 30 mg 7 days | Prednisolone 30 mg 14 days | Outcome not reported |
| Salam 1998 (abstract only) USA/Unknown sites | Not stated | Not stated | 21/Not known | Not stated | Not stated | None in previous month | IV CS 3 days | IV CS 3 days + 7 days OCS | Outcome not reported |
| Sayiner 2001 Turkey/1 site | FEV1 < 35% predicted, PYH > 20, no respiratory failure requiring ventilation | Not stated, requiring admission | 36/34 | 65 | 94/Not stated | None in previous month | IV methylprednisone 0.5 mg/kg qds 3 days | IV methylprednisone 0.5 mg/kg qds 3 days, bd 3 days, od 4 days | Required open‐label steroid treatment |
| Sirichana 2008 (abstract and author data) Thailand/1 site | Age > 40 years, symptoms > 24 hours | Increase in at least 2 of 3 symptoms—dyspnoea, sputum volume, sputum purulence; requiring admission | 48/42 | 73 | 88/Not stated | None in previous month | Prednisolone 30 mg 5 days | Prednisolone 30 mg 10 days | Outcome not reported |
| Wood‐Baker 1997 (abstract and author data) Australia & New Zealand/2 sites | Age > 40 years; > 10 pack‐year smoking history; FEV1 < 50% predicted | Not stated, requiring admission | 38/28 | 71 | 63/Not stated | None for current AEs, no long‐term OS > 5 mg/d | Prednisolone 2.5 mg/kg orally daily for 3 days | Prednisolone 0.6 mg/kg orally daily for 7 days followed by prednisolone 0.3 mg/kg orally daily for 7 days | Lack of progress according to attending physician during treatment |
All eight studies with a total of 582 participants were parallel‐group RCTs comparing systemic corticosteroid treatment for seven or fewer days versus treatment for longer than seven days in people with an acute exacerbation of COPD; all were conducted in hospital settings. These studies were published between 1997 and 2013. Two studies reported the definition for COPD diagnosis (Chen 2005; Leuppi 2013), and two studies specified the inclusion of participants with an FEV1 below 50% predicted (Gomaa 2008; Wood‐Baker 1997) or below 35% predicted (Sayiner 2001). Two studies (Leuppi 2013; Sirichana 2008) provided a specific symptom‐based definition of an acute exacerbation.
Studies varied in size from 21 to 314 participants; the mean age of participants was between 65 and 73 years, and the proportion of female participants ranged from 6% to 42% (in four studies that reported these data). Participants had severe to very severe COPD; in two studies baseline mean FEV1 ranged from 0.5 to 0.8 litres, and in two other studies baseline mean FEV1 ranged from 25% to 33% predicted.
Five studies used only oral prednisolone (Chen 2005; Gomaa 2008; Rahman 2004; Sirichana 2008; Wood‐Baker 1997) at a dose of 30 mg daily, except Wood‐Baker 1997, which provided oral prednisolone 2.5 mg/kg in the short‐duration arm and a tapered dose (0.6 mg/kg/d for seven days followed by 0.3 mg/kg/d for seven days) in the longer‐duration arm. Three studies used intravenous corticosteroid initially in both arms for 24 or 72 hours: methylprednisolone in Leuppi 2013 and Sayiner 2001, and an unspecified intravenous corticosteroid in Salam 1998. Participants then received systemic corticosteroids intravenously for seven days in Sayiner 2001 and orally for seven days in Salam 1998 in the longer‐duration arm. All participants in Leuppi 2013 received oral prednisone from day 2 onwards for the appropriate treatment duration.
Duration of treatment in the short‐course arm was three days in Salam 1998, Sayiner 2001 and Wood‐Baker 1997; five days in Leuppi 2013 and Sirichana 2008; and seven days in Chen 2005, Gomaa 2008 and Rahman 2004. The duration of longer‐course treatment was 10 days in Salam 1998, Sayiner 2001 and Sirichana 2008; 14 days in Gomaa 2008, Leuppi 2013, Rahman 2004 and Wood‐Baker 1997; and 15 days in Chen 2005.
Three studies were published as full papers (Chen 2005; Leuppi 2013; Sayiner 2001), and additional data were supplied by the study author for Chen 2005. Of five studies published only as abstracts in conference proceedings, data were supplied by authors for Sirichana 2008 and Wood‐Baker 1997. Despite at least two requests, no data were made available for Gomaa 2008, Rahman 2004 and Salam 1998.
Excluded studies
A total of 10 studies with reasons for exclusion are listed in Characteristics of excluded studies.
Risk of bias in included studies
The methodological quality of the published included trials was good; they were determined to have low risk of selection, performance, detection and attrition bias. Risk of bias was unclear in studies available only as abstracts (Figure 2 and Figure 3).
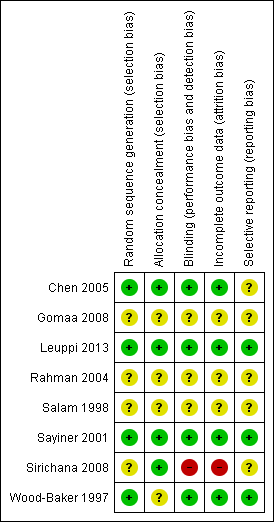
Risk of bias summary: review authors' judgements about each item for each included study.
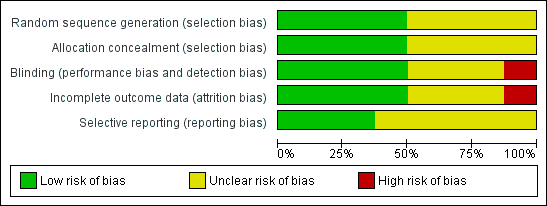
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
Allocation
In four studies (Chen 2005; Leuppi 2013; Sayiner 2001; Wood‐Baker 1997) the randomisation procedure was adequate, but sequence generation was unclear. Allocation concealment was adequate in four studies (Chen 2005; Leuppi 2013; Sayiner 2001; Sirichana 2008) but was not described in four studies.
Blinding
Four studies were double blind (Chen 2005; Leuppi 2013; Sayiner 2001; Wood‐Baker 1997). One study (Sirichana 2008) was not blinded to participants or investigators. Blinding was unclear in the three other studies, although one study (Gomaa 2008) stated that the study was single blinded but provided no further details.
Incomplete outcome data
Incomplete data were adequately addressed in four studies (Chen 2005; Leuppi 2013; Sayiner 2001; Wood‐Baker 1997), but risk of bias was judged high in Sirichana 2008 and was unclear in three studies.
Selective reporting
Three studies were assessed as free of selective reporting (Leuppi 2013; Sayiner 2001; Wood‐Baker 1997), but risk of bias was unclear in five studies.
Effects of interventions
Primary outcomes
1.1 Treatment failure
Four studies reported treatment failure that occurred during the index exacerbation, and the definition was provided in three studies (Table 1). No significant difference was noted in the likelihood of treatment failure between systemic corticosteroid for seven or fewer days and longer than seven days (n = 457; odds ratio (OR) 0.72, 95% confidence interval (CI) 0.36 to 1.46; Analysis 1.1; Figure 4), and no statistical heterogeneity was observed. This result is equivalent to 22 fewer treatment failures per 1000 (95% CI 51 fewer to 34 more). The outcome was downgraded for imprecision and was rated as having moderate quality because the confidence intervals for the pooled effect included important benefit and potential harm.

Forest plot outcome: treatment failure comparing systemic corticosteroids for ≤ 7 days vs > 7 days.
1.2 Relapse
Relapse was measured as a new acute exacerbation or hospital admission for COPD in four studies: Chen 2005 (follow‐up period not stated), Sayiner 2001 and Leuppi 2013 (six‐month follow‐up) and Sirichana 2008 (30‐day follow‐up). No significant difference was reported between systemic corticosteroid use for seven or fewer days and for longer than seven days (n = 478; OR 1.04, 95% CI 0.7 to 1.56; Analysis 1.2; Figure 5), and no statistical heterogeneity was observed. The outcome was downgraded for imprecision and was rated as having moderate quality because the confidence intervals for the pooled effect included important benefit and potential harm.
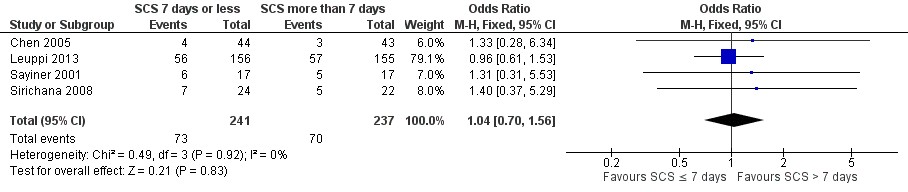
Forest plot of comparison: 1 Systemic corticosteroids for 7 or fewer days vs longer than seven days, outcome: 1.2 Relapse.
1.3 Time to re‐exacerbation
Time to next COPD exacerbation, defined as "acute‐onset worsening of the patient’s condition beyond day‐to‐day variations requiring interaction with a healthcare provider which could occur during the index exacerbation or during follow‐up," over six months of follow‐up was reported in one study (Leuppi 2013). This study adopted an a priori non‐inferiority definition, by which the proportion of participants with re‐exacerbation during follow‐up should be no more than 65% compared with 50% for standard treatment for an exacerbation, yielding a critical hazard ratio of 1.515. Time to the next exacerbation did not differ in this one large study, which was powered to detect non‐inferiority and compared five days versus 14 days of systemic corticosteroid treatment (n = 311; hazard ratio (HR) 0.95, 95% CI 0.66 to 1.37; Analysis 1.3).
1.4 to 1.6 Adverse effects
1.4 Hyperglycaemia: In two studies (Leuppi 2013; Sayiner 2001) no difference was noted in the likelihood of hyperglycaemia between systemic corticosteroid for seven or fewer days and longer than seven days (n = 345; OR 0.99, 95% CI 0.64 to 1.53; Analysis 1.4), and no heterogeneity was observed. The outcome was downgraded for imprecision and was rated as having moderate quality because the confidence intervals for the pooled effect included important benefit and potential harm.
1.5 Hypertension: In one trial (Leuppi 2013)no difference was noted in the likelihood of hypertension between systemic corticosteroid for seven or fewer days and longer than seven days (n = 311; OR 0.61, 95% CI 0.31 to 1.22; Analysis 1.5).
1.6 Other adverse effects were reported in five studies and included gastrointestinal tract bleeding, symptomatic gastrointestinal reflux, symptoms of congestive heart failure or ischaemic heart disease, sleep disturbance, fractures and depression. No difference was noted in the likelihood of another adverse event between systemic corticosteroids for seven or fewer days and longer than seven days (n = 503; OR 0.89, 95% CI 0.46 to 1.69; Analysis 1.6). The outcome was downgraded for imprecision and was rated as having moderate quality because the confidence intervals for the pooled effect included important benefit and potential harm.
Secondary outcomes
1.7 Mortality
In two studies the likelihood of mortality did not differ between systemic corticosteroid for seven or fewer days and longer than seven days (n = 336; OR 0.91, 95% CI 0.40 to 2.06; Analysis 1.7). The outcome was downgraded for imprecision and was rated as having moderate quality because the confidence intervals for the pooled effect included important benefit and potential harm.
1.8 Length of hospitalisation
In three studies no difference was noted in length of hospital stay between systemic corticosteroid for seven or fewer days and longer than seven days (n = 421; mean difference (MD) ‐0.61 days, 95% CI ‐1.51 to 0.28; Analysis 1.8). The outcome was downgraded for imprecision and was rated as having moderate quality because the confidence intervals for the pooled effect included important benefit and potential harm.
1.9 to 1.14 Lung function
In three studies no difference was noted in absolute FEV1 measured within seven days between systemic corticosteroid for seven or fewer days and longer than seven days (n = 96; MD ‐0.07 litres, 95% CI ‐0.19 to 0.05; Analysis 1.9), and no heterogeneity was observed. Leuppi 2013 reported lung function as FEV1 percentage predicted and noted no difference between systemic corticosteroid for seven or fewer days and longer than seven days (n = 289; MD 0.76%, 95% CI ‐3.15 to 4.66; Analysis 1.10). In three studies no difference was noted in early response of FVC between systemic corticosteroid for seven or fewer days and longer than seven days (n = 97; MD 0.01 L, 95% CI ‐0.20 to 0.22; Analysis 1.11), and no statistical heterogeneity was observed.
For lung function measured at the end of treatment in four studies, no difference was noted in FEV1 between systemic corticosteroid for seven or fewer days and longer than seven days (n = 187; MD ‐0.04 litres, 95% CI ‐0.19 to 0.10; Analysis 1.12); important heterogeneity was observed (Chi² = 7.17, df = 3 (P value 0.07), I² = 58%). The outcome was rated as having very low quality and was downgraded for imprecision because the confidence intervals for the pooled effect included important benefit and potential harm, and risk of attrition bias and inconsistency were due to unexplained heterogeneity. In Leuppi 2013, no difference was noted in FEV1 percentage predicted at 30 days between systemic corticosteroid for seven or fewer days and more than seven days (n = 289; MD 1.29%, 95% CI ‐3.35 to 5.93; Analysis 1.13). In three studies no difference was noted in FVC at the end of treatment between systemic corticosteroid for seven or fewer days and longer than seven days (n = 99; MD ‐0.12, 95% CI ‐0.33 to 0.09; Analysis 1.14), and no heterogeneity was observed.
1.15 to 1.17 Arterial blood gases
Sayiner 2001 reported partial pressure of oxygen in arterial blood (PaO2) before seven days (n = 34). No difference was noted between treatment with systemic corticosteroid for seven or fewer days and longer than seven days (MD ‐0.20 mmHg; 95% CI ‐9.21 to 8.81; Analysis 1.15).
In two studies (n = 121) at completion of treatment, no difference was noted in PaO2 after 10 to 14 days of follow‐up between systemic corticosteroid for seven or fewer days and longer than seven days (MD ‐1.38 mmHg; 95% CI ‐4.96 to 2.21; Analysis 1.16).
In Sayiner 2001 (n = 34) no difference was noted in partial pressure of carbon dioxide in arterial blood (PaCO2) after three days (MD ‐1.80 mmHg, 95% CI ‐11.14 to 7.54) or after 10 days (MD 1.50 mmHg, 95% CI ‐5.20 to 8.20) between treatment with systemic corticosteroid for seven or fewer days and longer than seven days (Analysis 1.17).
1.18 to 1.19 Symptom scores
In two studies no differences were noted in dyspnoea scores when measured before seven days between systemic corticosteroid for seven or fewer days and longer than seven days (n = 320; standardised mean difference (SMD) ‐0.08, 95% CI ‐0.29 to 0.14; Analysis 1.18), and no statistical heterogeneity was observed. When expressed on the Medical Research Council (MRC) scale (1 to 5), this would equate to 0.1 units better (95% CI 0.4 better to 0.2 worse).
In four studies at the end of treatment, no difference was noted in dyspnoea scores between systemic corticosteroid for seven or fewer days and longer than seven days (n = 404; SMD 0.16, 95% CI ‐0.03 to 0.36; Analysis 1.19),and moderate heterogeneity was observed (Chi² = 5.89, df = 3 (P value 0.12), I² = 49%). When expressed on the MRC scale (1 to 5), this would equate to 0.2 units worse (95% CI 0.04 better to 0.45 worse).
1.20 to 1.21 Quality of life
Health‐related quality of life was assessed in Leuppi 2013 by using the acute bronchitis health‐related quality‐of‐life interview, which measures changes in health‐related quality of life among patients treated for chronic lung disease; it consists of 22 items in four domains: activity‐related limitations (six items); effects of symptoms (eight items); fatigue (four items); and emotional functioning (four items). Each item is rated on a 7‐point scale, and a difference of 0·5 points is taken to be the smallest important difference (Evans 2002). No difference was reported in overall score between systemic corticosteroid for seven or fewer days and longer than seven days when measured before seven days (n = 290; MD 0.03, 95% CI ‐0.15 to 0.21; Analysis 1.20) or after 30 days (n = 263; MD 0.07, 95% CI ‐0.11 to 0.25; Analysis 1.21).
Discusión
Resumen de los resultados principales
Tratamiento con corticosteroides sistémicos durante siete días o menos en comparación con tratamiento con corticosteroides sistémicos durante más de siete días para las exacerbaciones agudas de la EPOC
Ver Resumen de los hallazgos para la comparación principal.
La probabilidad del fracaso del tratamiento no difirió entre el tratamiento con corticosteroides sistémicos durante siete días o menos y el de más de siete días luego de 10 a 14 días de seguimiento en cuatro estudios, aunque se informaron intervalos de confianza amplios alrededor del cálculo (457 participantes; odds ratio [OR] 0,72; intervalo de confianza [IC] del 95%: 0,36 a 1,46). Esta diferencia se equipara a 22 pacientes menos que presentan el fracaso del tratamiento por 1000 (IC del 95%: 51 menos a 34 más) para el tratamiento con corticosteroides de corta duración. De igual manera, no se observó ninguna diferencia para la nueva exacerbación luego de 14 a 180 días de seguimiento en cuatro estudios (478 participantes; OR 1,04; IC del 95%: 0,7 a 1,56); lo cual se equipara a nueve pacientes menos con nueva exacerbación por 1000 (IC del 95%: 68 menos a 100 más) durante el tratamiento con corticosteroides de duración más larga. El tiempo hasta la próxima exacerbación de la EPOC no difirió en un estudio amplio, con el poder estadístico suficiente para detectar la "no inferioridad", y que comparó cinco días versus 14 días de tratamiento con corticosteroides sistémicos (n = 311; cociente de riesgos instantáneos 0,95; IC del 95%: 0,66 a 1,37).
La probabilidad de efectos adversos del fármaco al comparar corticosteroides sistémicos administrados por siete días o menos versus corticosteroides sistémicos administrados por más de siete días no difirió para la hiperglucemia en dos estudios con datos de calidad moderada (n = 345; OR 0,99; IC del 95%: 0,64 a 1,53), ni para un rango de otros efectos del fármaco en cinco estudios con datos de baja calidad (n = 503; OR 0,88; IC del 95%: 0,46 a 1,69). La mortalidad durante el seguimiento de entre 14 días y 180 días no difirió en dos estudios (n = 336; OR 0,91; IC del 95%: 0,40 a 2,06) con datos de calidad moderada.
No se observó ninguna diferencia en la duración de la hospitalización en tres estudios (n = 421; DM ‐0,61 días, IC del 95%: ‐1,51 a 0,28) con datos de calidad moderada, y no se informaron diferencias en la función pulmonar al final del tratamiento en cuatro estudios (n = 187; diferencia de medias [DM] en el volumen espiratorio forzado en un segundo [VEF1] ‐0,04 L, IC del 95%: ‐0,19 a 0,10) con datos de muy baja calidad. No se observó ninguna diferencia en la calidad de vida relacionada con la salud en un estudio con datos de calidad moderada.
Compleción y aplicabilidad general de las pruebas
Cinco de los ocho estudios incluidos no fueron publicados como artículos completos. Los metanálisis se vieron limitados por la necesidad de omitir tres estudios, ya sea porque no se pudo extraer datos de los resúmenes o porque los autores no aportaron datos (Gomaa 2008; Rahman 2004; Salam 1998). El número pequeño de ensayos dio lugar a que no se realizaran análisis de subgrupos.
Un estudio (Wood‐Baker 1997) debió interrumpirse prematuramente por la dificultad para incorporar participantes que cumplieran con los criterios de inclusión, que especifican que los participantes no debían haber comenzado un tratamiento oral con esteroides antes del ingreso. Esta estipulación también causó niveles bajos de reclutamiento para el estudio en curso (Reid 2010). En muchos países es probable que lo anterior sea una barrera para la realización de estudios en pacientes hospitalizados que comparen el tratamiento con corticosteroides de corta duración versus duración convencional de hasta 14 días, debido a que las guías y los planes de acción recomiendan la iniciación temprana del tratamiento.
Debido a que esta revisión excluyó los estudios en los cuales los participantes eran sometidos a asistencia respiratoria (invasiva o no invasiva), los hallazgos no son generalizables a pacientes que reciben asistencia respiratoria. Las dosis del corticosteroide sistémico administrado a los pacientes de la unidad de cuidados intensivos (UCI) que pueden requerir asistencia respiratoria son generalmente mucho mayores que las administradas en los estudios incluidos en esta revisión (Kiser 2014). Un estudio observacional que evaluó la administración de corticosteroides en pacientes de la UCI con una exacerbación de la enfermedad pulmonar obstructiva crónica (EPOC) estableció la conclusión de que ocurrieron menos muertes y estadías más cortas en el hospital entre los pacientes tratados con corticosteroides sistémicos en dosis equivalentes a menos de 240 mg por día de metilprednisolona. Un estudio observacional que incluyó a pacientes de un contexto de cuidados no intensivos con una exacerbación de la EPOC que recibieron corticosteroides sistémicos no evaluó la duración del tratamiento; este estudio halló que los corticosteroides en dosis baja (20 a 80 mg/d de equivalente de prednisona) administrados por vía oral no se asociaron con peores resultados que los observados con el tratamiento intravenoso en dosis alta (120 a 800 mg/d de equivalente de prednisona) durante los dos primeros días en el hospital (Lindenauer 2010).
Calidad de la evidencia
Los estudios que contribuyeron al metanálisis estuvieron en riesgo bajo de sesgo de selección, aunque un estudio estuvo en riesgo alto de sesgo de realización y de detección a causa de la falta de cegamiento. Se observó alguna heterogeneidad entre los estudios con respecto a los criterios de inclusión. Muchos estudios no aportaron detalles de los criterios de inclusión, incluida la definición de las exacerbaciones agudas de la EPOC. Sólo tres estudios especificaron la gravedad de la EPOC de los pacientes sobre la base del análisis de la función pulmonar (VEF1) al ingreso. Los umbrales para definir la gravedad incluyeron el VEF1 con una predicción inferior al 50% en Gomaa 2008 y Wood‐Baker 1997, e inferior al 35% en Sayiner 2001. Se informó una variación en los corticosteroides sistémicos utilizados en los estudios incluidos: Cinco estudios usaron prednisolona oral, uno comenzó con una dosis inicial alta y continuó con una disminución progresiva (Wood‐Baker 1997), y dos estudios utilizaron corticosteroides por vía intravenosa. Sin embargo, se demostró que los corticosteroides por vía e intravenosa tenían la misma eficacia y, por tanto, no deberían contribuir a ninguna heterogeneidad (Therapeutic Guidelines 2009). Los análisis de sensibilidad según los riesgos de sesgo ocasionados por la falta de cegamiento o por la vía de administración del corticosteroide no tuvieron efectos significativos en los resultados agrupados (Tabla 2). La duración del seguimiento varió entre los estudios y no se mencionó en cuatro estudios. Los períodos de seguimiento posiblemente hayan sido demasiado cortos para detectar diferencias potenciales en la recaída, la mortalidad y la reinternación. La ausencia de datos para el agrupamiento limitó el análisis de algunos resultados que son importantes para los pacientes, como la calidad de vida.
Sesgos potenciales en el proceso de revisión
Los revisores hicieron todo lo posible por identificar todos los estudios relevantes publicados y no publicados mediante el uso de métodos adicionales para identificar los estudios que podrían no haberse encontrado durante la búsqueda electrónica principal (p.ej. búsquedas en las bases de datos de compañías farmacéuticas y sitios de registro de ensayos clínicos, verificación de las listas de control). No se estableció contacto sistemáticamente con los autores de los ensayos individuales para obtener datos adicionales a menos que los resultados claramente se hubiesen informado de forma selectiva. Todos los revisores se adhirieron a las mejores guías de práctica más recientes en cuanto a la selección de los estudios, la resolución de desacuerdos, la extracción de datos y el análisis para reducir el sesgo y el error. Se incluyeron todos los datos obtenidos a partir de los estudios incluidos, incluso los de los estudios en mayor riesgo de sesgo con respecto a las pérdidas de participantes, como en Sirichana 2008, aunque se realizó el análisis de sensibilidad para comprobar si la omisión del estudio cambiaba los resultados. Se obtuvieron datos para un estudio (Wood‐Baker 1997) de un autor de este equipo de revisión; Sin embargo, la extracción y el análisis de datos se realizaron de la misma manera que para los otros estudios.

Risk of bias summary: review authors' judgements about each item for each included study.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Forest plot outcome: treatment failure comparing systemic corticosteroids for ≤ 7 days vs > 7 days.

Forest plot of comparison: 1 Systemic corticosteroids for 7 or fewer days vs longer than seven days, outcome: 1.2 Relapse.
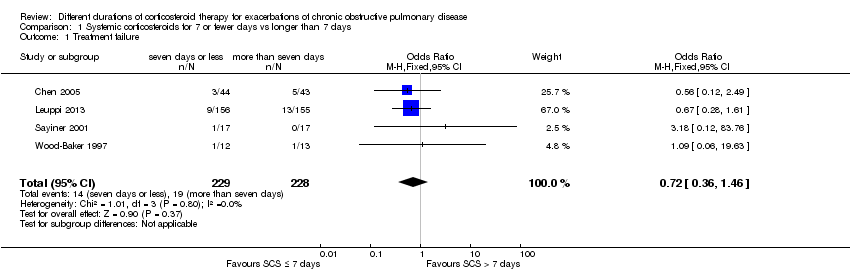
Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 1 Treatment failure.

Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 2 Relapse.

Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 3 Time to re‐exacerbation.

Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 4 Adverse effect—hyperglycaemia.

Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 5 Adverse effect—hypertension.

Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 6 Other adverse effects—gastrointestinal tract bleeding, symptomatic gastrointestinal reflux, symptoms of congestive heart failure or ischaemic heart disease, sleep disturbance, fractures, depression.
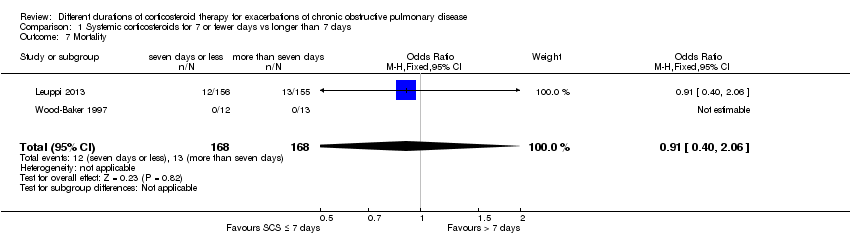
Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 7 Mortality.
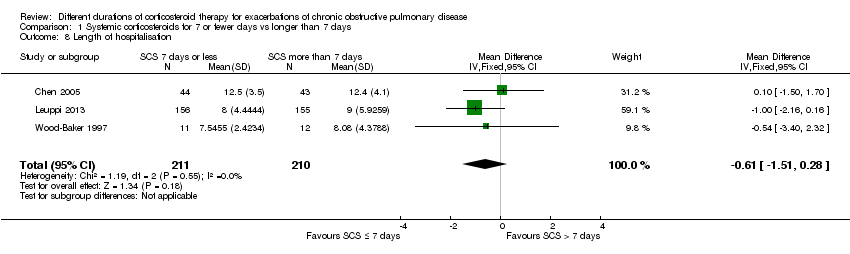
Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 8 Length of hospitalisation.

Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 9 FEV1 (L) (early).
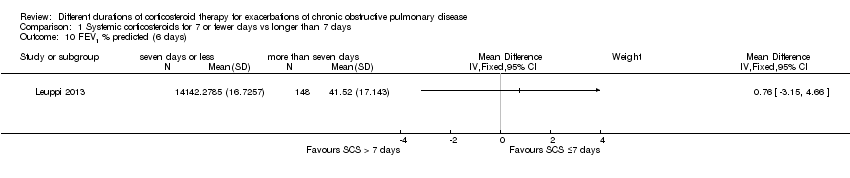
Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 10 FEV1 % predicted (6 days).
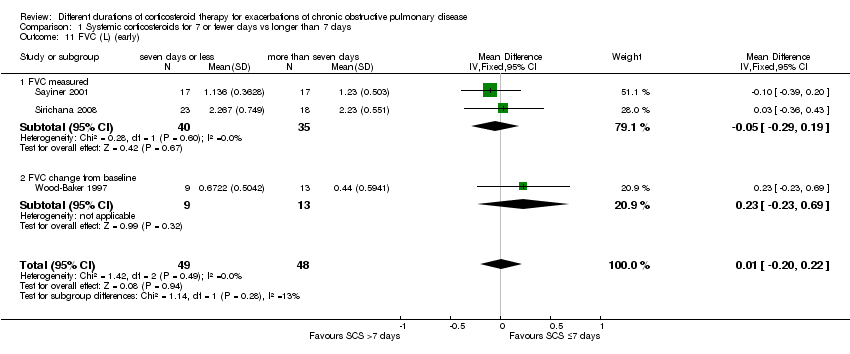
Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 11 FVC (L) (early).

Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 12 FEV1 (L) end of treatment.

Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 13 FEV1 % predicted 30 days.

Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 14 FVC (L) end of treatment.

Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 15 PaO2 (mmHg) (early).
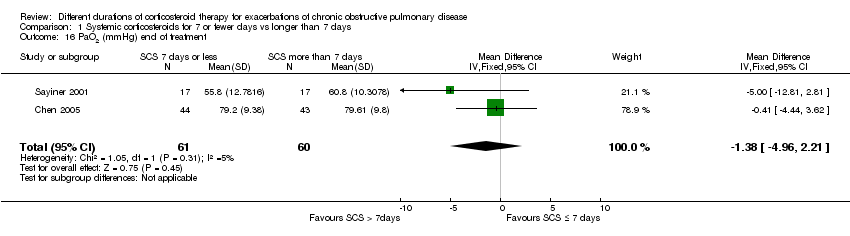
Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 16 PaO2 (mmHg) end of treatment.

Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 17 PaCO2 (mmHg).
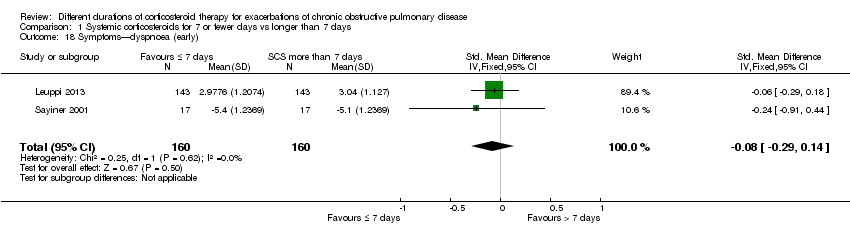
Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 18 Symptoms—dyspnoea (early).

Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 19 Symptoms—dyspnoea (15 days).

Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 20 Quality of life—overall (6 days).
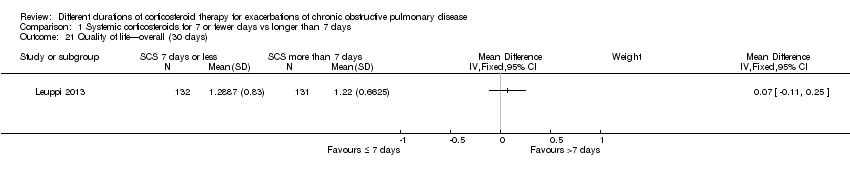
Comparison 1 Systemic corticosteroids for 7 or fewer days vs longer than 7 days, Outcome 21 Quality of life—overall (30 days).
| SCS treatment for 7 or fewer days compared with SCS treatment for longer than 7 days for acute exacerbations of COPD | ||||||
| Patient or population: patients with acute exacerbations of COPD | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| SCS treatment for longer than 7 days | SCS treatment for 7 or fewer days | |||||
| Treatment failure | 83 per 1000 | 61 per 1000 | OR 0.72 | 457 | ⊕⊕⊕⊝ | Equivalent to 22 fewer (95% CI 51 fewer to 34 more) |
| Relapse | 295 per 1000 | 304 per 1000 | OR 1.04 | 478 | ⊕⊕⊕⊝ | In one study (Leuppi 2013), hazard ratio for time to re‐exacerbation was 0.95 (95% CI 0.66 to 1.37) |
| Adverse drug effect—hyperglycaemia | 442 per 1000 | 439 per 1000 | OR 0.99 | 345 | ⊕⊕⊕⊝ | |
| Adverse drug effects | 84 per 1000 | 75 per 1000 | OR 0.88 | 503 | ⊕⊕⊝⊝ | |
| Mortality | 77 per 1000 | 71 per 1000 | OR 0.91 | 336 | ⊕⊕⊕⊝ | |
| Length of hospitalisation | Mean length of hospitalisation in control groups was | Mean length of hospitalisation in intervention groups was | 421 | ⊕⊕⊕⊝ | ||
| Lung function (end of treatment) | Mean FEV1 in control groups ranged from 0.84 to 1.14 L | Mean lung function (end of treatment) in intervention groups was | 187 | ⊕⊝⊝⊝ | ||
| Health‐related quality of life (QOL) Overall score (includes activity limitations, symptoms, fatigue, emotional functioning); scale 0 best to 6 worst; minimum important difference 0.5 Follow‐up: 30 days | Mean QOL score in control groups was 1.24 | Mean QOL score in intervention groups was 0.06 higher (‐0.16 lower to 0.28 higher) | 271 (1 study) | ⊕⊕⊕⊝ | ||
| *The basis for the assumed risk (e.g. median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aWide confidence intervals include significant benefit or harm (‐1 for imprecision). | ||||||
| Study ID/Setting | Inclusion criteria | AE definition | N participants included/Completing | Mean age, years | % males/ % smokers | Prestudy SCS use, % | SCS ≤ 7 days | SCS > 7 days | Definition of treatment failure |
| Chen 2005 China/ inpatients | 2 years of continuous productive cough, FEV1/FVC post BD < 0.7, FEV1 < 80% predicted. No respiratory failure, diabetes or bronchial asthma | At least 2 of 3 symptoms: increased sputum or dyspnoea or purulent sputum | 86/81 | 71 | 75/44 | Not stated | Prednisolone 30 mg 7 days | Prednisolone 30 mg/d 10 days + 15 mg/d 5 days | Not known |
| Gomaa 2008 (abstract only) | FEV1 < 50% predicted, no respiratory acidosis | Not stated | 42/Not known | Not stated | Not stated | Not stated | Prednisolone 30 mg 7 days | Prednisolone 30 mg 15 days | Outcome not reported |
| Leuppi 2013 Switzerland/5 sites | Age > 40 years, smoking history ≥ 20 pack‐years | At least 2 of the following: change in baseline dyspnoea, cough or sputum quantity/purulence | 314/296 | 69 | 60/45 | 20 | 5 days: days 1 to 4 methylprednisolone 40 mg, days 2 to 5 oral prednisolone 40 mg | 14 days: days 1 to 4 methylprednisolone 40 mg, days 2 to 14 oral 40 mg prednisolone | Received open‐label glucocorticoids during index exacerbation |
| Rahman 2004 (abstract only) Bangladesh/1 site | Not stated | Not stated | Not stated | Not stated | Not stated | Not stated | Prednisolone 30 mg 7 days | Prednisolone 30 mg 14 days | Outcome not reported |
| Salam 1998 (abstract only) USA/Unknown sites | Not stated | Not stated | 21/Not known | Not stated | Not stated | None in previous month | IV CS 3 days | IV CS 3 days + 7 days OCS | Outcome not reported |
| Sayiner 2001 Turkey/1 site | FEV1 < 35% predicted, PYH > 20, no respiratory failure requiring ventilation | Not stated, requiring admission | 36/34 | 65 | 94/Not stated | None in previous month | IV methylprednisone 0.5 mg/kg qds 3 days | IV methylprednisone 0.5 mg/kg qds 3 days, bd 3 days, od 4 days | Required open‐label steroid treatment |
| Sirichana 2008 (abstract and author data) Thailand/1 site | Age > 40 years, symptoms > 24 hours | Increase in at least 2 of 3 symptoms—dyspnoea, sputum volume, sputum purulence; requiring admission | 48/42 | 73 | 88/Not stated | None in previous month | Prednisolone 30 mg 5 days | Prednisolone 30 mg 10 days | Outcome not reported |
| Wood‐Baker 1997 (abstract and author data) Australia & New Zealand/2 sites | Age > 40 years; > 10 pack‐year smoking history; FEV1 < 50% predicted | Not stated, requiring admission | 38/28 | 71 | 63/Not stated | None for current AEs, no long‐term OS > 5 mg/d | Prednisolone 2.5 mg/kg orally daily for 3 days | Prednisolone 0.6 mg/kg orally daily for 7 days followed by prednisolone 0.3 mg/kg orally daily for 7 days | Lack of progress according to attending physician during treatment |
| Excluding Sirichana (not blinded) | All studies | |
| Relapse | 1.01 (0.66 to 1.55) | 1.04 (0.70 to 1.56) |
| FEV1 early | ‐0.09 (‐0.22 to 0.05) | ‐0.07 (‐0.19 to 0.05) |
| FEV1 end | ‐0.06 (‐0.23 to 0.11) | ‐0.04 (‐0.19 to 0.10) |
| FVC early | ‐0.00 (‐0.25 to 0.25) | 0.01 (‐0.20 to 0.22) |
| FVC end | ‐0.14 (‐0.38 to 0.09) | ‐0.12 (‐0.33 to 0.09) |
| Adverse event—other | 0.94 (0.48 to 1.82) | 0.89 (0.46 to 1.69) |
| Excluding Sayiner (IV SCS) | All studies | |
| Treatment failure | 0.66 (0.32 to 1.37) | 0.72 (0.36 to 1.46) |
| Relapse | 1.02 (0.67 to 1.56) | 1.04 (0.70 to 1.56) |
| Adverse event—hyperglycaemia | 0.99 (0.63 to 1.54) | 0.99 (0.64 to 1.53) |
| Adverse event—other | 0.89 (0.46 to 1.69) | 0.89 (0.46 to 1.69) |
| FEV1 early | ‐0.02 (‐0.19 to 0.16) | ‐0.07 (‐0.19 to 0.05) |
| FEV1 end | 0.03 (‐0.06 to 0.12) | ‐0.04 (‐0.19 to 0.10) |
| FVC early | 0.12 (‐0.18 to 0.42) | 0.01 (‐0.20 to 0.22) |
| FVC end | ‐0.06 (‐0.34 to 0.22) | ‐0.12 (‐0.33 to 0.09) |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Treatment failure Show forest plot | 4 | 457 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.72 [0.36, 1.46] |
| 2 Relapse Show forest plot | 4 | 478 | Odds Ratio (M‐H, Fixed, 95% CI) | 1.04 [0.70, 1.56] |
| 3 Time to re‐exacerbation Show forest plot | 1 | Hazard Ratio (Fixed, 95% CI) | Subtotals only | |
| 4 Adverse effect—hyperglycaemia Show forest plot | 2 | 345 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.99 [0.64, 1.53] |
| 5 Adverse effect—hypertension Show forest plot | 1 | Odds Ratio (M‐H, Fixed, 95% CI) | Subtotals only | |
| 6 Other adverse effects—gastrointestinal tract bleeding, symptomatic gastrointestinal reflux, symptoms of congestive heart failure or ischaemic heart disease, sleep disturbance, fractures, depression Show forest plot | 5 | 503 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.89 [0.46, 1.69] |
| 7 Mortality Show forest plot | 2 | 336 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.91 [0.40, 2.06] |
| 8 Length of hospitalisation Show forest plot | 3 | 421 | Mean Difference (IV, Fixed, 95% CI) | ‐0.61 [‐1.51, 0.28] |
| 9 FEV1 (L) (early) Show forest plot | 3 | 96 | Mean Difference (IV, Fixed, 95% CI) | ‐0.07 [‐0.19, 0.05] |
| 9.1 FEV1 absolute | 2 | 75 | Mean Difference (IV, Fixed, 95% CI) | ‐0.08 [‐0.22, 0.06] |
| 9.2 FEV1 change | 1 | 21 | Mean Difference (IV, Fixed, 95% CI) | ‐0.04 [‐0.27, 0.19] |
| 10 FEV1 % predicted (6 days) Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 11 FVC (L) (early) Show forest plot | 3 | 97 | Mean Difference (IV, Fixed, 95% CI) | 0.01 [‐0.20, 0.22] |
| 11.1 FVC measured | 2 | 75 | Mean Difference (IV, Fixed, 95% CI) | ‐0.05 [‐0.29, 0.19] |
| 11.2 FVC change from baseline | 1 | 22 | Mean Difference (IV, Fixed, 95% CI) | 0.23 [‐0.23, 0.69] |
| 12 FEV1 (L) end of treatment Show forest plot | 4 | 187 | Mean Difference (IV, Random, 95% CI) | ‐0.04 [‐0.19, 0.10] |
| 12.1 FEV1 measured | 3 | 164 | Mean Difference (IV, Random, 95% CI) | ‐0.05 [‐0.25, 0.16] |
| 12.2 FEV1 change from baseline | 1 | 23 | Mean Difference (IV, Random, 95% CI) | ‐0.04 [‐0.23, 0.14] |
| 13 FEV1 % predicted 30 days Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 14 FVC (L) end of treatment Show forest plot | 3 | 99 | Mean Difference (IV, Fixed, 95% CI) | ‐0.12 [‐0.33, 0.09] |
| 14.1 FVC measured | 2 | 77 | Mean Difference (IV, Fixed, 95% CI) | ‐0.14 [‐0.39, 0.11] |
| 14.2 FVC change from baseline | 1 | 22 | Mean Difference (IV, Fixed, 95% CI) | ‐0.07 [‐0.44, 0.29] |
| 15 PaO2 (mmHg) (early) Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 16 PaO2 (mmHg) end of treatment Show forest plot | 2 | 121 | Mean Difference (IV, Fixed, 95% CI) | ‐1.38 [‐4.96, 2.21] |
| 17 PaCO2 (mmHg) Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 17.1 3 days of follow‐up | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 17.2 10 days of follow‐up | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 18 Symptoms—dyspnoea (early) Show forest plot | 2 | 320 | Std. Mean Difference (IV, Fixed, 95% CI) | ‐0.08 [‐0.29, 0.14] |
| 19 Symptoms—dyspnoea (15 days) Show forest plot | 4 | 404 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.16 [‐0.03, 0.36] |
| 19.1 Change | 3 | 133 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.25 [‐0.09, 0.60] |
| 19.2 Absolute | 1 | 271 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.12 [‐0.12, 0.36] |
| 20 Quality of life—overall (6 days) Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 21 Quality of life—overall (30 days) Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |

