Erradicación del Helicobacter pylori para la prevención del cáncer gástrico
Resumen
Antecedentes
El cáncer gástrico es la tercera causa más frecuente de muerte por cáncer en todo el mundo. Los individuos con infección por Helicobacter pylori tienen una mayor probabilidad de desarrollar cáncer gástrico que los individuos que no están infectados. La erradicación del H. pylori en individuos asintomáticos sanos de la población general puede reducir la incidencia de cáncer gástrico, pero la magnitud de este efecto es incierta.
Objetivos
Evaluar la efectividad de la erradicación del H. pylori en individuos asintomáticos sanos de la población general para reducir la incidencia del cáncer gástrico.
Métodos de búsqueda
Se identificaron ensayos mediante búsquedas en el Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials) (CENTRAL; 2013, número 11), MEDLINE (1946 hasta diciembre 2013) y en EMBASE (1974 hasta diciembre 2013). Se realizaron búsquedas manuales en las listas de los ensayos seleccionados mediante la búsqueda electrónica para identificar los ensayos relevantes adicionales. Se realizaron búsquedas manuales de los resúmenes publicados en las actas de congresos de la United European Gastroenterology Week (publicados en Gut) y de la Digestive Disease Week (publicados en Gastroenterology) entre 2001 y 2013. Además, se contactó con los miembros del Grupo Cochrane de Enfermedades Esófago‐gástricas, del Intestino Delgado y Pancreáticas y expertos en el tema, y se les solicitó que brindaran detalles de ensayos clínicos destacados y cualquier material relevante no publicado.
Criterios de selección
Se analizaron los ensayos controlados aleatorios que compararan al menos una semana de tratamiento para el H. pylori con placebo o ningún tratamiento en la prevención de la aparición posterior del cáncer gástrico en adultos, sin otra patología y asintomáticos, con pruebas positivas para el H. pylori. Los ensayos debían realizar el seguimiento de los participantes durante al menos dos años y tener al menos dos participantes con cáncer gástrico como resultado. Se definió el cáncer gástrico como cualquier adenocarcinoma gástrico, incluido el tipo intestinal (diferenciado) o difuso (indiferenciado), con o sin histología específica.
Obtención y análisis de los datos
Se recopilaron los datos sobre la incidencia de cáncer gástrico, la incidencia de cáncer esofágico, las muertes por cáncer gástrico, las muertes por cualquier causa y los efectos adversos debidos al tratamiento.
Resultados principales
Seis ensayos cumplieron todos los criterios de elegibilidad y proporcionaron datos extraíbles. Tres ensayos fueron de bajo riesgo de sesgo, un ensayo estaba en riesgo incierto, y dos ensayos se encontraban en alto riesgo de sesgo. Se realizaron cinco ensayos en poblaciones asiáticas. Al prevenir la aparición de un cáncer gástrico posterior, el tratamiento para el H. pylori fue superior al placebo o ningún tratamiento (seis ensayos, 6497 participantes, cociente de riesgos [CR] de desarrollo de cáncer gástrico posterior 0,66; intervalo de confianza [IC] del 95%: 0,46 a 0,95; pruebas de calidad moderada). Sólo un ensayo informó el efecto de la erradicación del H. pylori en el desarrollo de cáncer esofágico posterior (2 [0,2%] de 817 participantes asignados al tratamiento de erradicación, en comparación con 1 [0,1%] de 813 participantes asignados al placebo; CR 1,99; IC del 95%: 0,18 a 21,91). El efecto de la erradicación del H. pylori en la prevención de la muerte por cáncer gástrico comparado con el placebo o ningún tratamiento fue incierto debido a los amplios intervalos de confianza (tres ensayos, 4475 participantes, CR 0,67; IC del 95%: 0,40 a 1,11; pruebas de calidad moderada). No hubo pruebas de un efecto sobre la mortalidad por todas las causas (cuatro ensayos, 5253 participantes, CR 1,09; IC del 95%: 0,86 a 1,38; pruebas de calidad moderada). Los datos de los eventos adversos se informaron de forma deficiente.
Conclusiones de los autores
Se hallaron pruebas limitadas y de calidad moderada de que la búsqueda y la erradicación del H. pylori reducen la incidencia de cáncer gástrico en individuos asiáticos con infección pero asintomáticos y sanos; sin embargo, no necesariamente pueden extrapolarse estos datos a otras poblaciones.
PICOs
Resumen en términos sencillos
Tratamiento contra el Helicobacter pylori para la prevención del cáncer de estómago
Pregunta de la revisión
Si la realización de pruebas de detección delHelicobacter pylori en individuos sanos y el tratamiento sistemático de los infectados con un ciclo de antibióticos reduce el número de nuevos casos de cáncer gástrico.
Antecedentes
Los individuos con infección por H. pylori tienen mayor probabilidad de desarrollar cáncer gástrico que los pacientes que no están infectados por la bacteria. Por este motivo, el H. pylori se clasifica como carcinogénico (productor de cáncer) en seres humanos. Muchas personas mueren a causa del cáncer gástrico cada año en todo el mundo, porque para cuando los afectados consultan a un médico, la enfermedad se encuentra por lo general en un estadio avanzado. Sin embargo, la infección por H. pylori se trata fácilmente con un ciclo de una semana de antibióticos.
Características de los estudios
Una búsqueda en la literatura hasta diciembre 2013 encontró seis ensayos (con 6497 participantes, tres ensayos con bajo riesgo de sesgo). Cinco de los estudios se realizaron en Asia.
Resultados clave
Se halló que los antibióticos para el H. pylori tienen un pequeño beneficio en la prevención del cáncer gástrico (51 [1,6%] de 3294 participantes que recibieron tratamiento desarrollaron un cáncer gástrico posterior, en comparación con 76 [2,4%] de 3203 que no recibieron ningún tratamiento o recibieron un placebo). Sin embargo, no puede precisarse si disminuyen el número de muertes por la enfermedad, aumenta o disminuye el número de muertes por cualquier causa, o aumenta o disminuye el número de casos de cáncer esofágico. Los datos acerca de los efectos secundarios del tratamiento se informaron de forma deficiente.
Calidad de la evidencia
Tres ensayos fueron de bajo riesgo de sesgo, un ensayo estaba en riesgo incierto, y dos ensayos se encontraban en alto riesgo de sesgo. Un estudio tuvo un alto riesgo de sesgo porque no se usó ningún placebo para el régimen de tratamiento de erradicación activo, por lo que esta parte del ensayo no fue cegada; y el otro estudio tuvo un alto riesgo de sesgo a causa de las incongruencias en el informe de datos en los dos puntos de seguimiento. No se pudo resolver esta discrepancia a pesar de contactar con los autores originales. Como resultado, se disminuyó la calidad de las pruebas de alta a moderada por el riesgo de sesgo significativo.
Conclusiones de los autores
Summary of findings
| H. pylori eradication therapy compared to control for the prevention of gastric neoplasia in healthy asymptomatic infected individuals | ||||||
| Patient or population: healthy asymptomatic H. pylori‐infected individuals | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control | H. pylori eradication therapy to prevent subsequent gastric cancer | |||||
| Incidence of gastric cancer ‐ modified ITT analysis | 24 per 1000 | 16 per 1000 | RR 0.66 | 6497 | ⊕⊕⊕⊝ | Number needed to treat to benefit was 124 (95% CI 78 to 843) |
| Death from gastric cancer ‐ modified ITT analysis | 16 per 1000 | 11 per 1000 | RR 0.67 | 4475 | ⊕⊕⊕⊝ | |
| Death from all causes ‐ modified ITT analysis | 67 per 1000 | 73 per 1000 | RR 1.09 | 5253 | ⊕⊕⊕⊝ | |
| Incidence of oesophageal squamous cell carcinoma ‐ modified ITT analysis | 1 per 1000 | 2 per 1000 | RR 1.99 | 1630 | ⊕⊕⊕⊝ | |
| Adverse events | See comment | See comment | Not estimable | 0 | See comment | Adverse events were poorly reported across the studies and could not be summarised. |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 As all but one study was conducted in East Asia, it is not possible to assess the effect of searching for and eradicating H. pylori in Western populations. | ||||||
Antecedentes
Descripción de la afección
El cáncer gástrico es la tercera causa más común de muerte por enfermedades malignas en todo el mundo, y da lugar a 750 000 muertes cada año(Ferlay 2010). En la mayoría de los países de ingresos altos, la incidencia de cáncer gástrico está descendiendo, (Lau 2006),aunque el aumento de la edad en la población global significa que el número total de muertes por cáncer gástrico va a aumentar en el futuro previsible (Forman 1998). El tratamiento del cáncer gástrico es insatisfactorio. Casi la mitad de los casos de cáncer gástrico son inoperables en el momento del diagnóstico(Lello 2007), y la supervivencia a cinco años de estos individuos es cercana a cero. Los que reciben tratamiento quirúrgico a menudo requieren intervención quirúrgica extensiva, y presentan una tasa de supervivencia a cinco años de sólo un 20% a un 30% (Cunningham 2005). La supervivencia puede mejorar si la enfermedad se diagnostica en un estadio más temprano (Degiuli 2006),aunque el costo de la detección del cáncer gástrico en la población con endoscopia del aparato digestivo superior sería prohibitivo. Aunque sólo se realizara la detección con endoscopia en los pacientes con síntomas del aparato digestivo superior que pueden ser indicativos de un cáncer gástrico oculto, como la dispepsia, se calcula que el costo de la detección de una lesión maligna alcanzaría los USD 83 000. (Vakil 2009) Por lo tanto, una forma posible de tener una influencia significativa sobre la mortalidad por cáncer gástrico podría ser a través de la prevención primaria de la enfermedad.
El descubrimiento del Helicobacter pylori y la observación de que fue responsable del desarrollo de gastritis crónica, con atrofia gástrica y metaplasia intestinal posteriores, planteó la posibilidad de que este microorganismo fuese un contribuyente necesario al proceso carcinogénico en la mayoría de los casos de cáncer gástrico (Correa 1975; Correa 1983; Marshall 1985; Warren 1983). Los estudios anidados de casos y controles tempranos confirmaron que los individuos con infección por H. pylori presentaban entre tres y seis veces más probabilidades de desarrollar cáncer gástrico, en comparación con los controles no infectados (Forman 1991; Nomura 1991; Parsonnet 1991). Esta observación dio lugar a que la Organización Mundial de la Salud y la International Agency Research on Cancer concluyeran que el H. pylori fue un carcinógeno de clase I (IARC 1994).
Una revisión sistemática y metanálisis que identificó 12 estudios de casos y controles prospectivos anidados indicaron que el H. pylori se asoció con un aumento casi triple de las probabilidades de desarrollar cáncer gástrico no cardias (HCCG 2001). Una política de realizar pruebas de detección en las poblaciones en alto riesgo de cáncer gástrico para el H. pylori con una prueba no invasiva, como la prueba de carbono‐urea en el aire espirado, y el tratamiento de los pacientes con infección podría dar lugar, teóricamente, a una reducción en la incidencia de cáncer gástrico (Parsonnet 1996). Sin embargo, los profesionales sanitarios no han considerado seriamente esta política, y es poco probable que lo hagan hasta que los ensayos controlados aleatorios (ECA) hayan mostrado que un programa de detección de este tipo es efectivo. También existen inquietudes a partir de los estudios anidados de casos y controles de que el riesgo de adenocarcinoma esofágico aumenta en los pacientes sin infección por H. pylori, aunque estos datos son menos consistentes (Wu 2003; Ye 2004). Estas inquietudes provienen de la teoría de que la erradicación del H. pylori puede inducir síntomas de reflujo gastroesofágico en algunos individuos y por lo tanto, un mayor riesgo de esófago de Barrett y adenocarcinoma esofágico.
La única revisión sistemática de los ECA publicada en forma completa informó una reducción significativa del riesgo relativo de desarrollar cáncer gástrico con el tratamiento de erradicación del H. pylori, en comparación con placebo (Fuccio 2009). Sin embargo, los autores incluyeron datos del mismo ensayo dos veces, en dos puntos de seguimiento diferentes (Ford 2009). Cuándo sólo se incluyeron los datos de uno u otro de estos puntos de seguimiento, el efecto ya no fue estadísticamente significativo. Debido a que han pasado cinco años desde la publicación de este metanálisis, es posible que ahora pueda haber más ensayos publicados, así como una duración más larga del seguimiento en los ensayos existentes, lo cual dio lugar a la nueva evaluación de este tema.
Descripción de la intervención
El tratamiento de erradicación del H. pylori consta de antibióticos, solos o en combinación con tratamiento supresor de ácidos, bismuto, o ambos. El tratamiento triple basado en el inhibidor de la bomba de protones sigue siendo el “valor de referencia” para el tratamiento de la infección por H. pylori. Con el desarrollo de métodos exactos de diagnóstico de la infección por H. pylori, se ha convertido en algo relativamente directo confirmar el tratamiento exitoso, o la erradicación, de la infección.
De qué manera podría funcionar la intervención
Hay mecanismos biológicamente verosímiles que pueden explicar la asociación entre el H. pylori y el cáncer gástrico. La infección da lugar a un estado hiperproliferativo, se reduce la concentración intragástrica de ácido ascórbico, y aumentan los niveles de metabolitos de oxígeno reactivos de la mucosa capaces de provocar daño en el ADN. La erradicación del H. pylori normaliza el recambio celular gástrico, las concentraciones de ácidos ascórbicos luminales y el nivel de especies de oxígeno reactivo en la mucosa (Moayyedi 1997).
Por qué es importante realizar esta revisión
El método de detección en la población y el tratamiento de la infección por H. pylori pueden reducir la incidencia de cáncer gástrico, en particular en los habitantes con una alta prevalencia de infección con la bacteria, que también presentan un alto riesgo de cáncer gástrico. El objetivo de esta revisión sistemática y metanálisis de ECA fue evaluar el efecto del tratamiento de erradicación del H. pylori en la prevención del cáncer gástrico en individuos con pruebas positivas para el H. pylori que son asintomáticos y no presentan otra patología.
Objetivos
Evaluar la efectividad de la erradicación del H. pylori en individuos asintomáticos sanos de la población general para reducir la incidencia del cáncer gástrico.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Sólo se consideraron los ECA de grupos paralelos que comparaban la erradicación del H. pylori con placebo o ningún tratamiento para esta revisión.
Tipos de participantes
Adultos sanos y asintomáticos sin otras patologías a partir de los 16 años de edad con pruebas positivas para el H. pylori, según lo evaluado de forma invasiva con cualquier histología, prueba rápida de urasa, cultivo (todos de biopsias de antro o cuerpo obtenidas con endoscopia), o de forma no invasiva a través de serología del H. pylori o prueba de carbono‐urea en el aire espirado.
Tipos de intervenciones
El régimen de tratamiento de erradicación del H. pylori debía tener una tasa de erradicación como se ha informado en la bibliografía de al menos un 50% y se definió como cualquiera de los siguientes, con una duración del tratamiento de al menos una semana:
-
Tratamiento dual con inhibidor de la bomba de protones (IBP) (IBP más amoxicilina o claritromicina);
-
tratamiento triple con IBP (IBP más cualquiera de los dos siguientes: amoxicilina, macrólido, 5‐nitroimidazol);
-
tratamiento triple con antagonista del receptor de histamina2 (H2RA, por sus siglas en inglés) (H2RA más cualquiera de los dos siguientes: amoxicilina, macrólido, 5‐nitroimidazol);
-
tratamiento triple con bismuto (sal de bismuto y 5‐nitroimidazol con amoxicilina o tetraciclina);
-
tratamiento cuádruple con bismuto (como el tratamiento triple con bismuto, pero con el agregado de un IBP);
-
tratamiento dual con citrato de bismuto de ranitidina (RBC, por sus siglas en inglés) (RBC más amoxicilina o claritromicina);
-
tratamiento triple con RBC (RBC más cualquiera de los dos siguientes: amoxicilina, macrólido, 5‐nitroimidazol);
-
Monoterapia con claritromicina.
Los tratamientos mencionados se compararon con placebo o ningún tratamiento.
En los ensayos que fueron de diseño factorial y que incluían la evaluación de los suplementos alimentarios (por ejemplo vitamina C o selenio), así como la erradicación del H. pylori, el análisis principal incluyó brazos que habían asignado al azar a todos los participantes al tratamiento de erradicación o al placebo o a ningún tratamiento, de forma independiente de la asignación a estos suplementos.
Tipos de medida de resultado
El seguimiento de los participantes debía haberse realizado durante al menos dos años, y los ensayos debían informar datos sobre la incidencia posterior de cáncer gástrico como un resultado. Se definió el cáncer gástrico como cualquier adenocarcinoma gástrico, incluido el tipo intestinal (diferenciado) o difuso (indiferenciado), o sin histología específica.
Resultados primarios
Evaluar la proporción de individuos con pruebas positivas para el H. pylori asignados al azar para recibir tratamiento de erradicación que desarrollaron cáncer gástrico, en comparación con los que recibieron placebo o ningún tratamiento.
Resultados secundarios
Se evaluaron los siguientes resultados secundarios en participantes con pruebas positivas para el H. pylori asignados al azar para la erradicación del H. pylori en comparación con placebo o ningún tratamiento:
-
proporción de individuos que desarrollaron adenocarcinoma esofágico;
-
proporción de individuos que desarrollaron carcinoma escamocelular esofágico;
-
proporción de individuos que murieron por cáncer gástrico;
-
proporción de individuos que murieron por cualquier causa;
-
proporción de eventos adversos (como diarrea, erupción cutánea, náuseas o vómitos, cefalea, sabor alterado) dicotomizados en presentes o ausentes.
Results
Description of studies
See: Characteristics of included studies and Characteristics of excluded studies.
Results of the search
In total, we identified 1560 citations using the search strategy outlined above (Figure 1). We reviewed the titles and abstracts and thought 56 articles to be potentially eligible for inclusion. Of these, 15 were not RCTs (Hamajima 2002; Hsu 2007; Juibari 2003; Kamangar 2006; Kato 2006; Kim 2008; Mabe 2009; Ogura 2008; Ohkusa 2001; Take 2005; Take 2007; Takenaka 2007; Uemura 2001; Uemura 2002; Yanaoka 2009); 3 were RCTs comparing the interventions of interest, but their primary objective was to study the effect of H. pylori eradication therapy on dyspepsia in the community, and they did not report any gastric cancer data (Harvey 2004; Moayyedi 2000; Wildner‐Christensen 2003); and 2 were RCTs, but with no incident gastric cancers occurring during follow‐up, and therefore did not meet our eligibility criteria for inclusion (Fischbach 2001; Miehlke 2001). In the latter five studies, we contacted the lead or senior authors to ask for the most up‐to‐date information from the most recent follow‐up point of the study, in order to ensure that we were not excluding these articles injudiciously. In all cases, the authors responded and stated that there had been no incident gastric cancers reported at the last point of follow‐up. Another four articles were duplicate publications of studies already classified as ineligible. (Ford 2005; Imanzadeh 2004; Lane 2006; Mason 2002) Two studies were RCTs conducted among patients undergoing endoscopic mucosal resection of early gastric cancer (Choi 2014; Fukase 2008), rather than healthy asymptomatic infected participants, and the final article did not compare the interventions of interest (Fischbach 2009).

Study flow diagram for RCTs
This left 29 separate papers, reporting on 6 separate RCTs that compared H. pylori eradication therapy with placebo or no treatment and providing data on subsequent incidence of gastric cancer, which therefore appeared to be eligible for inclusion. However, 19 of these articles were preliminary or duplicate publications, or protocols of eligible RCTs, and provided no new information or did not report outcomes of interest, and were therefore excluded from the meta‐analysis (Feng 2008; Li 2013; Mera 2005; Ruiz 2001; Saito 2003; Sung 2000; Sung 2002; Wang 2009; Wong 2002; Wong 2012b; You 2001; Zhang 1998; Zhang 2006; Zhou 2003a; Zhou 2003b; Zhou 2003c; Zhou 2005a; Zhou 2005b; Zhou 2005c), leaving 10 papers that reported unique and extractable data (Correa 2000; Correa 2001; Gail 1998; Leung 2004; Ma 2012; Saito 2005; Wong 2004; Wong 2012a; You 2006; Zhou 2008). One of these studies only reported adverse events data (Gail 1998). Therefore, six studies with nine references contributed data to the analyses concerning incidence of gastric cancer in this systematic review.
Included studies
Please see Characteristics of included studies table. Three of the trials, reported in five separate publications, were of factorial design with some participants randomised to receive vitamins, antioxidants, or celecoxib in addition to H. pylori eradication therapy (Correa 2000; Wong 2012a; You 2006). Only one study was conducted in non‐Asians, among a population at high risk of gastric cancer in Colombia (Correa 2000). The shortest duration of follow‐up was greater than or equal to 4 years (Saito 2005), and the longest was 14.7 years (You 2006). The largest study contained 2258 participants (You 2006), and the smallest 513 participants (Wong 2012a).
Excluded studies
Please see Characteristics of excluded studies table.
Risk of bias in included studies
Three trials were at low risk of bias (Wong 2004; Wong 2012a; You 2006), one trial was at unclear risk (Saito 2005), and two trials were at high risk of bias (Correa 2000; Leung 2004) (Figure 2; Figure 3). One study was at high risk of bias because no placebo comparator was used for the active eradication therapy regimen, and therefore this part of the trial was unblinded (Correa 2000); the other study was at high risk of bias due to inconsistencies in data reporting at the two points of follow‐up, with 10 gastric cancers reported at 5 years (Leung 2004), compared with 9 at 10 years (Zhou 2008). Despite contacting the original authors, we were unable to resolve this discrepancy satisfactorily. In the case of this trial, we used data from the 10‐year follow‐up in our primary analysis, but substituted the 5‐year data in a sensitivity analysis.
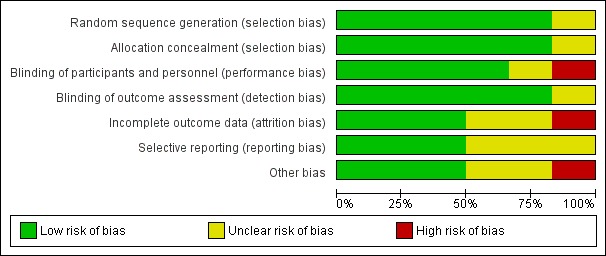
'Risk of bias' graph: review authors' judgements about each 'Risk of bias' item presented as percentages across all included studies.

'Risk of bias' summary: review authors' judgements about each 'Risk of bias' item for each included study.
Allocation
Random sequence generation
We considered five studies to be at low risk of bias for random sequence generation: three studies generated the allocation sequence by a computer (Correa 2000; Leung 2004; Wong 2004), and two studies generated the assignments by a company (Wong 2012a; You 2006). We considered one study, in abstract form, to be at unclear risk of bias for random sequence generation, as no information was provided regarding the randomisation process (Saito 2005).
Allocation concealment
We considered five studies to be at low risk of bias for allocation concealment: three studies allocated participants by sealed envelopes (Leung 2004; Wong 2004 ), and two studies involved central allocation (Correa 2000; Wong 2012a; You 2006). One study, in abstract form, had uncertain concealment (Saito 2005).
Blinding
Blinding of participants, health providers, data collectors, and outcome assessors should be possible for this type of eradication study. We considered four double‐blind, placebo‐controlled studies to be at low risk of bias for blinding of participants and personnel, as well as blinding of outcome assessors (Leung 2004; Wong 2004; Wong 2012a; You 2006). Pathologists were blinded in two studies (Correa 2000; Leung 2004), one of which was considered a double‐blind study because a placebo was used (Leung 2004). We considered Correa 2000 to be at high risk of bias for blinding of participants and personnel because an appropriate placebo was not available for bismuth subsalicylate, and double blinding only applied to the dietary supplements versus placebo part of the trial. We considered this study to be at low risk of bias for blinding of outcome assessment because pathologists were blinded. One study, in abstract form, had uncertain risk of bias for blinding (Saito 2005).
Incomplete outcome data
We considered one study to be at high risk of bias for incomplete outcome data (Leung 2004). We used data from the conference proceeding, Zhou 2008, for the main analysis, because follow‐up was for 10 years, while data in the full publication, Leung 2004a, had only 5 years of follow‐up. However, Zhou 2008 had a smaller sample size (552 versus 587) and reported a smaller number of gastric cancers than Leung 2004. According to Leung 2004, 152 participants (26% of 587) were lost to follow‐up, therefore there would be more than 26% participants lost to follow‐up after 2004. We considered three studies to be at unclear risk of bias (Correa 2000; Saito 2005; You 2006). In one study, the average rate of loss was 4.3% per year over the 6‐year trial; withdrawals in the 72 months of follow‐up were 117 (26.8%) versus 104 (25%) in all H. pylori eradication arms versus control arms (Correa 2000). However, it is likely that participants who had cancer would have come back for treatment, although these individuals did not complete follow‐up. One conference proceeding did not provide detailed information (Saito 2005). We considered three studies to be at low risk of bias, because the numbers of participants who were lost to follow‐up were balanced between treatment arms and were fewer than 20% (Wong 2004; Wong 2012a; You 2006).
Selective reporting
Three studies reported all important outcomes, and we therefore considered them to be at low risk of bias for selective reporting (Wong 2004; Wong 2012a; You 2006). We considered three studies to be at unclear risk of bias. In one of these studies, death from gastric cancer was not reported (Correa 2000). In another study, mortality data were reported in the 2004 full publication (Leung 2004a), but not in the 2008 conference proceeding (Zhou 2008), which led to an inconsistent sample size between the incidence of gastric cancer and mortality analyses (Leung 2004). One study, reported in abstract form, did not provide any mortality data (Saito 2005).
Other potential sources of bias
We considered one study to be at high risk of bias for other potential sources of bias, due to inconsistent data noted between serial publications (Leung 2004). We identified a total of 10 publications from this study (Leung 2004; Sung 2000; Sung 2002; Zhou 2003a; Zhou 2003b; Zhou 2003c; Zhou 2005a; Zhou 2005b; Zhou 2005c; Zhou 2008), with the latest conference abstract, Zhou 2008, having a smaller sample size and fewer gastric cancer cases than the full publication. Specifically, 10 gastric cancer cases were reported at 5 years, compared with only 9 at 10 years. We considered two studies to be at unclear risk for other potential sources of bias. One was in abstract format (Saito 2005), and the other demonstrated an inconsistent sample size between the full publication, which reported data at 7.5 years (817 versus 813) (Wong 2004), and the conference abstract, which reported data at 7 years (819 versus 809) (Wong 2002).
Effects of interventions
Effect of H. pylori eradication therapy, compared with placebo or no therapy, on development of subsequent gastric cancer
All six trials reported a dichotomous outcome for subsequent incidence of gastric cancer. In our primary, modified intention‐to‐treat (ITT) analysis, we included all arms in the two trials of factorial design that also randomised participants to receive antioxidants or vitamins, as well as the 10‐year follow‐up data from Zhou 2008. Overall, 51 (1.6%) of 3294 participants assigned to eradication therapy subsequently developed gastric cancer, compared with 76 (2.4%) of 3203 participants allocated to placebo or no treatment. There was no statistically significant heterogeneity between individual trial results (heterogeneity test, I2 = 0%, P = 0.60). Therefore there was a small, but statistically significant, benefit of H. pylori eradication therapy in preventing gastric cancer in healthy asymptomatic infected individuals (risk ratio (RR) 0.66; 95% confidence interval (CI) 0.46 to 0.95) (NNTB = 124; 95% CI 78 to 843) (Analysis 1.1).
We performed several sensitivity analyses when pooling data from these six trials. In our complete case analysis, where all participants for whom data were missing or unavailable were excluded from the analysis altogether, the RR of developing subsequent gastric cancer was 0.66 (95% CI 0.46 to 0.94) (Analysis 1.2). When we performed a modified ITT analysis, substituting the 10‐year follow‐up data from Zhou et al. with the 5‐year follow‐up data from Leung et al., the RR of developing gastric cancer was 0.69 (95% CI 0.49 to 0.98) (Analysis 4.1). When we performed a complete case analysis, but substituted the 10‐year follow‐up data from Zhou 2008 with the 5‐year follow‐up data from Leung 2004a, the RR was 0.69 (95% CI 0.48 to 0.98) (Analysis 4.2). When we performed a modified ITT analysis, but also included the celecoxib arms from the trial by Wong et al., the RR was 0.69 (95% CI 0.48 to 0.97) (Analysis 4.3). When we included all randomised participants from Correa 2000 and You 2006 in the analysis, that is we also included participants who were found to be ineligible after randomisation or those who did not take any medication (the most strict ITT definition), the RR was 0.67 (95% CI 0.47 to 0.95) (Analysis 4.4). Finally, we performed two data imputation analyses. If we assumed the incidence of gastric cancer for missing participants in both arms was the same as that observed in the trial control arm, the RR was 0.66 (95% CI 0.47 to 0.94). If we assumed the incidence of gastric cancer for missing participants in the treatment arm was the same as that observed in the trial control arm, but there were no new gastric cancer cases in the control arm among those with missing data, the RR was 0.69 (95% CI 0.48 to 0.98) (Analysis 4.5). We can therefore be reasonably confident that our conclusions are robust, regardless of the assumptions made about missing data.
Effect of H. pylori eradication therapy, compared with placebo or no therapy, on development of subsequent gastric cancer according to presence or absence of preneoplastic lesions at baseline
We found no evidence of any benefit of H. pylori eradication therapy in preventing the subsequent occurrence of gastric cancer when we considered only those with preneoplastic lesions at baseline in the analysis. Overall, 42 (2.4%) of 1734 participants assigned to eradication therapy subsequently developed gastric cancer, compared with 57 (3.4%) of 1691 participants allocated to placebo or no treatment (RR 0.86; 95% CI 0.47 to 1.59) (Analysis 2.1). There was no statistically significant heterogeneity between individual trial results (heterogeneity test, I2 = 23%, P = 0.27). Nor was there evidence of any benefit of H. pylori eradication therapy in preventing subsequent occurrence of gastric cancer when only those participants without preneoplastic lesions at baseline were considered in the analysis. Four (0.4%) of 894 participants randomised to receive eradication therapy subsequently developed gastric cancer, compared with 9 (1.0%) of 918 participants who were assigned to placebo (RR 0.42; 95% CI 0.02 to 7.69) (Analysis 2.1). There was statistically significant heterogeneity between individual trial results (heterogeneity test, I2 = 70%, P = 0.07). It should be noted that there would be reduced power to detect significant differences in these subgroup analyses.
Effect of H. pylori eradication therapy, compared with placebo or no therapy, on development of subsequent gastric cancer according to whether participants were co‐administered vitamins or antioxidants
We found no evidence of any benefit of H. pylori eradication therapy in preventing subsequent occurrence of gastric cancer when we considered only those participants who received eradication therapy alone in the analysis. Overall, 30 (1.4%) of 2116 participants assigned to eradication therapy alone subsequently developed gastric cancer, compared with 35 (1.7%) of 2044 participants allocated to placebo or no treatment alone (RR 0.82; 95% CI 0.46 to 1.45). There was no statistically significant heterogeneity between individual trial results (heterogeneity test, I2 = 13%, P = 0.33) (Analysis 3.1). However, when we considered those participants receiving eradication therapy in combination with antioxidants or vitamins in the analysis, 21 (1.8%) of 1178 participants randomised to receive eradication therapy and antioxidants or vitamins subsequently developed gastric cancer, compared with 41 (3.5%) of 1159 participants who were assigned to placebo or no treatment plus antioxidants or vitamins (RR 0.52; 95% CI 0.31 to 0.87). There was no statistically significant heterogeneity between individual trial results (heterogeneity test, I2 = 0%, P = 0.51) (Analysis 3.1). Again, it should be noted that there would be reduced power to detect significant differences in these subgroup analyses, .
Effect of H. pylori eradication therapy, compared with placebo or no therapy, on development of subsequent oesophageal cancer
Only one of the trials reported these data (Wong 2004). Two (0.2%) of 817 participants assigned to eradication therapy developed oesophageal cancer, compared with 1 (0.1%) of 813 participants allocated to placebo (RR 1.99; 95% CI 0.18 to 21.91, P = 0.57). All three cases were squamous cell cancers (Analysis 1.5).
Effect of H. pylori eradication therapy, compared with placebo or no therapy, on death from gastric cancer
Three studies, containing 4475 participants, provided data on mortality from gastric cancer (Leung 2004; Wong 2004; You 2006). Follow‐up ranged from 5 years to 14.7 years. Overall, there were 24 deaths (1.1%) from gastric cancer among 2242 participants randomised to eradication therapy, compared with 36 (1.6%) deaths in 2233 participants receiving placebo. There was no statistically significant heterogeneity between individual trial results (heterogeneity test, I2 = 0%, P = 0.90). There was no evidence of any benefit of H. pylori eradication therapy in preventing death from gastric cancer in healthy asymptomatic infected individuals (RR 0.67; 95% CI 0.40 to 1.11) (Analysis 1.3).
Effect of H. pylori eradication therapy, compared with placebo or no therapy, on all‐cause mortality
Four studies, containing 5253 participants, provided data on all‐cause mortality (Correa 2000; Wong 2004; Wong 2012a; You 2006). Follow‐up ranged from 6 to 14.7 years. Overall, 192 (7.3%) of 2639 participants receiving eradication therapy were dead at last point of follow‐up, compared with 175 (6.7%) of 2614 participants receiving placebo or no treatment. There was no statistically significant heterogeneity between individual trial results (heterogeneity test, I2 = 6%, P = 0.36). There was no evidence of any benefit of H. pylori eradication therapy in preventing death from any cause in healthy asymptomatic infected individuals (RR 1.09; 95% CI 0.86 to 1.38) (Analysis 1.4).
Adverse events with H. pylori eradication therapy, compared with placebo or no therapy
Only one of the studies we identified reported individual adverse events data with eradication therapy compared with placebo or no treatment (Gail 1998). The authors reported that there was no statistically significant difference in the incidence of adverse events with eradication therapy, with the exception of skin rash, which occurred in 3.1% of those receiving eradication therapy compared with 0.1% of those allocated placebo. Another study reported that side effects were monitored closely, and none of any clinical importance were detected, although no dichotomous data were reported to support this statement (Correa 2000).
Discusión
Resumen de los resultados principales
Esta revisión sistemática y metanálisis sugieren que la búsqueda y la erradicación de la infección por H. pylori en individuos saludables y asintomáticos infectados reduce la incidencia posterior de cáncer gástrico. El riesgo de cáncer gástrico posterior con el tratamiento de erradicación se redujo en un 34%, y el número necesario a tratar para prevenir un caso de cáncer gástrico fue de 124. El tamaño del efecto observado siguió siendo consistente a través de la mayoría de los análisis de sensibilidad realizados. No fue posible confirmar o refutar si algún beneficio del tratamiento de la erradicación del H. pylori dependió de la presencia o la ausencia de lesiones preneoplásicas al inicio. Sin embargo, es importante destacar que habría un poder estadístico reducido para detectar diferencias significativas en la mayoría de los análisis de subgrupos realizados, y los ensayos originales no tuvieron el poder estadístico adecuado con las variables de evaluación secundarias, como la mortalidad por cáncer gástrico o el efecto sobre el cáncer esofágico, en mente. Finalmente, hubo pocos casos de cáncer esofágico posterior, y los datos de los eventos adversos se informaron de manera deficiente en los estudios identificados. Tampoco se observó un impacto de la erradicación del H. pylori en la mortalidad por todas las causas. Esta variable de evaluación sería la más consistente para examinar aunque, como el cáncer gástrico representa sólo una proporción pequeña de la tasa de mortalidad general, el tamaño de la muestra para los ensayos necesitaría ser sumamente grande.
Compleción y aplicabilidad general de las pruebas
Como todos menos uno de los ensayos elegibles identificados se realizaron en poblaciones asiáticas, y el otro ensayo en una población sudamericana, no es posible evaluar el efecto del método de detección y el tratamiento del H. pylori en individuos sanos y asintomáticos de las poblaciones occidentales. Además, ninguno de los ECA identificados informó datos sobre los eventos adversos individuales, lo cual significa que no fue posible evaluar el equilibrio de los efectos beneficiosos y perjudiciales si fuera a adoptarse el método de detección en la población y el tratamiento de la infección por H. pylori como una medida de salud pública.
Calidad de la evidencia
Sólo tres de los ECA identificados estaban en bajo riesgo de sesgo (Wong 2012a; You 2006), un ensayo estaba en riesgo incierto porque se informó en forma de resumen (Saito 2005), y un ensayo estuvo en riesgo incierto debido a que se evaluó como incierto para otro riesgo de sesgo debido al tamaño de la muestra inconsistente entre los datos de informe de publicaciones completas a los 7,5 años,Wong 2004, y el resumen de conferencias que informó datos a los siete años,Wong 2002. Dos ensayos presentaron un alto riesgo de sesgo(Correa 2000; Leung 2004). En Correa 2000,este hecho se debió a que no se utilizó ningún comparador de placebo para el régimen de tratamiento de erradicación activa, y, por lo tanto, esta parte del ensayo no fue cegada, y en Leung 2004 el mismo se debió a las incongruencias en el informe de datos en los dos momentos del seguimiento, con diez casos de cáncer gástrico informados a los cinco años, en comparación con nueve a los diez años (Zhou 2008). A pesar de contactar con los autores originales, no se pudo resolver esta discrepancia de manera satisfactoria.
Sesgos potenciales en el proceso de revisión
Hubo limitaciones de esta revisión debido a la calidad y las características de la bibliografía publicada identificada, que se han destacado anteriormente. Debido al diseño factorial de algunos de los ensayos, también fue difícil evaluar si la reducción significativa en el riesgo de cáncer gástrico posterior se debió al tratamiento de erradicación del H. pylori solo, o a los antioxidantes o las vitaminas que fueron coadministradas en algunos de los ensayos. Sin duda, el efecto beneficioso del tratamiento de erradicación pareció ser más pronunciado en los dos estudios que coadministraron antioxidantes y vitaminas a los participantes, lo cual sugiere que puede haber habido algún beneficio adicional derivado de estos suplementos, aunque el poder para demostrar la modificación del efecto debido a estos diferentes tratamientos nuevamente es limitado. Sin embargo, debe señalarse que uno de estos ensayos contuvo la mayoría de los casos de cáncer gástrico, y tuvo la duración más larga del seguimiento de casi 15 años.
Acuerdos y desacuerdos con otros estudios o revisiones
Una revisión sistemática y metanálisis anterior que examinó este tema hace cinco años informaron que hubo un beneficio de la erradicación del H. pylori para prevenir la aparición futura de cáncer gástrico(Fuccio 2009). La magnitud de este efecto fue muy similar al observado, con un CR del cáncer gástrico posterior de 0,65 (IC del 95%: 0,43 a 0,98). Sin embargo, los autores del metanálisis incluyeron datos del mismo ensayo dos veces, tanto a los cinco como a los diez años de seguimiento (Leung 2004). Cuando sólo se incluyeron los datos del seguimiento a los cinco o diez años (Leung 2004a; Zhou 2008),el efecto del tratamiento de erradicación sobre la incidencia de cáncer gástrico ya no fue estadísticamente significativo, con un CR del cáncer gástrico en los participantes asignados al tratamiento de erradicación, en comparación con los asignados al placebo, de 0,65 (IC del 95%: 0,42 a 1,01) y 0,70 (IC del 95%: 0,46 a 1,08), respectivamente (Ford 2009; Ford 2011). La diferencia en el tamaño del efecto observado a partir de estos dos últimos análisis se debió a un estudio elegible adicional que se publicó en los años intermedios(Wong 2012a), así como a una duración más larga del seguimiento en otro estudio anteriormente elegible(You 2006).
Aunque estos datos indican que el método de detección de la población y el tratamiento del H. pylori pueden reducir la incidencia de cáncer gástrico, los IC del 95% son amplios y el resultado depende en gran medida de un estudio (You 2006). Sin embargo, hay datos de otras fuentes que apoyan estos hallazgos. Dos ECA no enmascarados han indicado que la erradicación del H. pylori puede reducir la incidencia futura de un cáncer metacrónico entre los pacientes que han tenido una resección endoscópica de la mucosa del cáncer gástrico (Choi 2014; Fukase 2008). En la Isla Matsu en Taiwán, donde en 2004 se adoptó el método de detección de la población y el tratamiento, la prevalencia de H. pylori disminuyó de un 63% al inicio a menos del 14% durante los cuatro años posteriores, y la prevalencia de atrofia gástrica disminuyó de casi un 60% a menos del 14% (Lee 2013). Al mismo tiempo, la incidencia promedio a cinco años del cáncer gástrico descendió de 40,3 por 100 000 personas‐años a 30,4; lo cual produjo un cociente de tasas de 0,75 (IC del 95%: 0,37 a 1,52), en un momento en el que la incidencia del cáncer gástrico en otros sitios de Taiwán seguía sin alteraciones. Sin embargo, la intervención no afectó la incidencia de metaplasia intestinal, lo cual apoya de forma adicional la teoría de que hay un “punto de no retorno” en los cambios histológicos inducidos por el H. pylori más allá de los cuales la prevención del cáncer mediante la erradicación de la infección ya no es posible. No hubo ningún efecto significativo sobre la mortalidad por cáncer gástrico observado durante el período de este estudio, aunque el seguimiento estuvo limitado a cuatro años, que es más corto que todos los estudios incluidos en el metanálisis excepto uno. Finalmente, la prevalencia de esofagitis erosiva en la endoscopia del aparato digestivo superior aumentó de un 14% al inicio a un 27% en 2008; lo cual sugiere posibles efectos nocivos del método de detección de la población y el tratamiento para la infección por H. pylori, debido a la posibilidad de un mayor riesgo de adenocarcinoma esofágico a largo plazo. Lo anterior fue algo que se procuraba evaluar en el metanálisis, aunque el informe incompleto de los casos de cáncer esofágico entre los estudios incluidos impidió lograrlo.

Study flow diagram for RCTs

'Risk of bias' graph: review authors' judgements about each 'Risk of bias' item presented as percentages across all included studies.

'Risk of bias' summary: review authors' judgements about each 'Risk of bias' item for each included study.
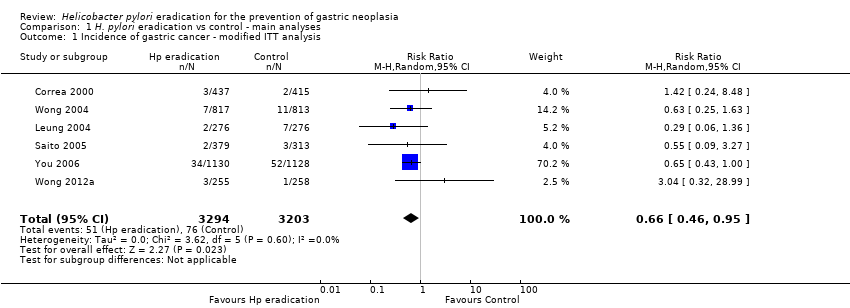
Comparison 1 H. pylori eradication vs control ‐ main analyses, Outcome 1 Incidence of gastric cancer ‐ modified ITT analysis.
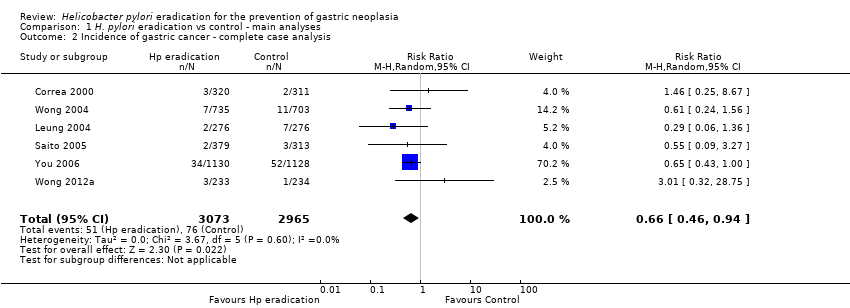
Comparison 1 H. pylori eradication vs control ‐ main analyses, Outcome 2 Incidence of gastric cancer ‐ complete case analysis.

Comparison 1 H. pylori eradication vs control ‐ main analyses, Outcome 3 Death from gastric cancer ‐ modified ITT analysis.

Comparison 1 H. pylori eradication vs control ‐ main analyses, Outcome 4 Death from all causes ‐ modified ITT analysis.
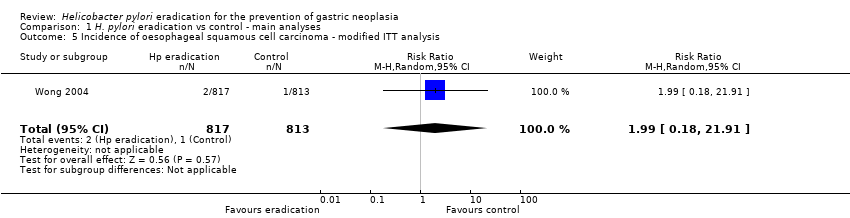
Comparison 1 H. pylori eradication vs control ‐ main analyses, Outcome 5 Incidence of oesophageal squamous cell carcinoma ‐ modified ITT analysis.
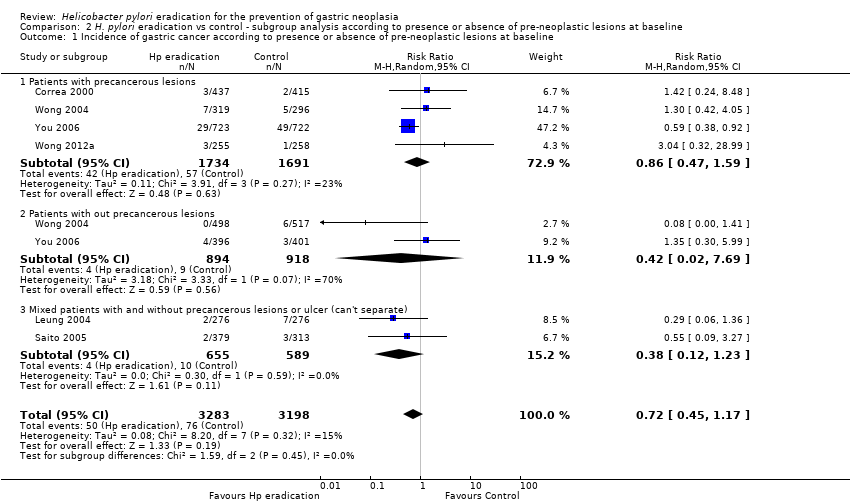
Comparison 2 H. pylori eradication vs control ‐ subgroup analysis according to presence or absence of pre‐neoplastic lesions at baseline, Outcome 1 Incidence of gastric cancer according to presence or absence of pre‐neoplastic lesions at baseline.

Comparison 3 H. pylori eradication vs control ‐ subgroup analysis according to use of vitamins or antioxidants, Outcome 1 Incidence of gastric cancer according to use of vitamins or anti‐oxidants.

Comparison 4 H. pylori eradication vs control ‐ sensitivity analyses, Outcome 1 Incidence of gastric cancer ‐ modified ITT analysis substituting the 10‐year follow‐up data from Zhou 2008 with the 5‐year follow‐up data from Leung 2004.

Comparison 4 H. pylori eradication vs control ‐ sensitivity analyses, Outcome 2 Incidence of gastric cancer ‐ complete case analysis substituting the 10‐year follow‐up data from Zhou 2008 with the 5‐year follow‐up data from Leung 2004.
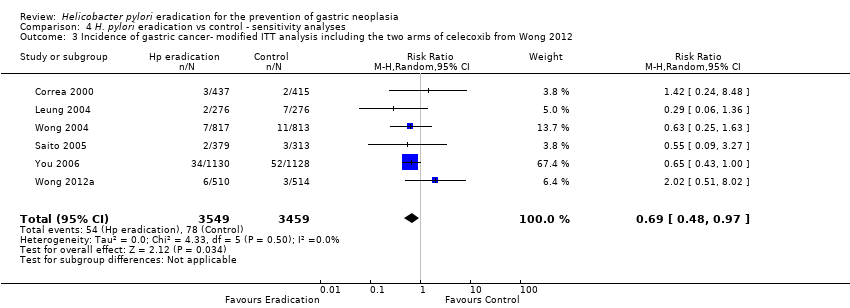
Comparison 4 H. pylori eradication vs control ‐ sensitivity analyses, Outcome 3 Incidence of gastric cancer‐ modified ITT analysis including the two arms of celecoxib from Wong 2012.
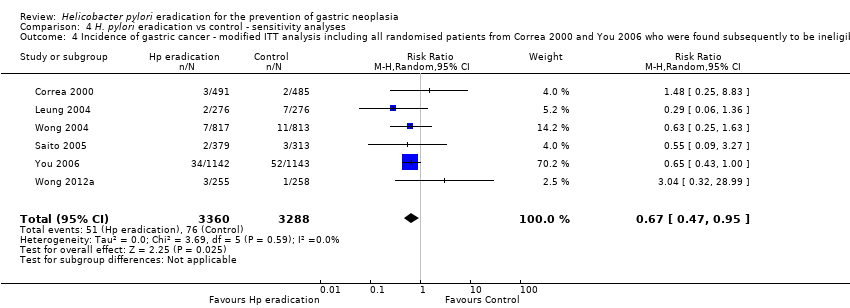
Comparison 4 H. pylori eradication vs control ‐ sensitivity analyses, Outcome 4 Incidence of gastric cancer ‐ modified ITT analysis including all randomised patients from Correa 2000 and You 2006 who were found subsequently to be ineligible or did not receive treatment.
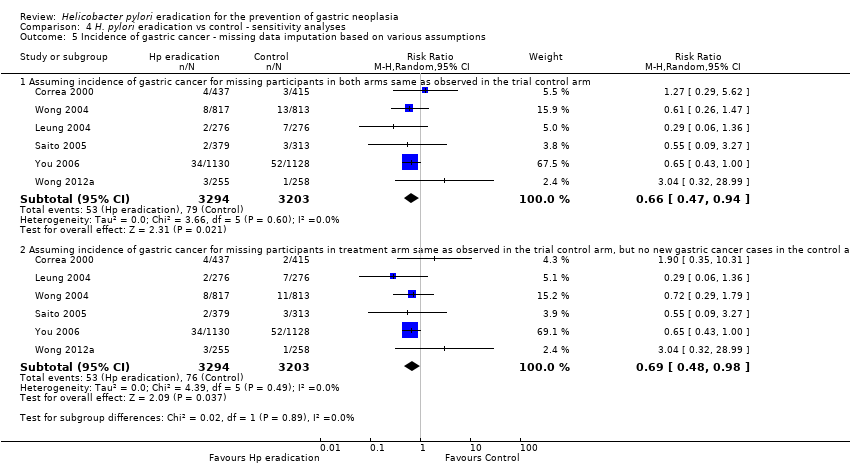
Comparison 4 H. pylori eradication vs control ‐ sensitivity analyses, Outcome 5 Incidence of gastric cancer ‐ missing data imputation based on various assumptions.
| H. pylori eradication therapy compared to control for the prevention of gastric neoplasia in healthy asymptomatic infected individuals | ||||||
| Patient or population: healthy asymptomatic H. pylori‐infected individuals | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control | H. pylori eradication therapy to prevent subsequent gastric cancer | |||||
| Incidence of gastric cancer ‐ modified ITT analysis | 24 per 1000 | 16 per 1000 | RR 0.66 | 6497 | ⊕⊕⊕⊝ | Number needed to treat to benefit was 124 (95% CI 78 to 843) |
| Death from gastric cancer ‐ modified ITT analysis | 16 per 1000 | 11 per 1000 | RR 0.67 | 4475 | ⊕⊕⊕⊝ | |
| Death from all causes ‐ modified ITT analysis | 67 per 1000 | 73 per 1000 | RR 1.09 | 5253 | ⊕⊕⊕⊝ | |
| Incidence of oesophageal squamous cell carcinoma ‐ modified ITT analysis | 1 per 1000 | 2 per 1000 | RR 1.99 | 1630 | ⊕⊕⊕⊝ | |
| Adverse events | See comment | See comment | Not estimable | 0 | See comment | Adverse events were poorly reported across the studies and could not be summarised. |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 As all but one study was conducted in East Asia, it is not possible to assess the effect of searching for and eradicating H. pylori in Western populations. | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Incidence of gastric cancer ‐ modified ITT analysis Show forest plot | 6 | 6497 | Risk Ratio (M‐H, Random, 95% CI) | 0.66 [0.46, 0.95] |
| 2 Incidence of gastric cancer ‐ complete case analysis Show forest plot | 6 | 6038 | Risk Ratio (M‐H, Random, 95% CI) | 0.66 [0.46, 0.94] |
| 3 Death from gastric cancer ‐ modified ITT analysis Show forest plot | 3 | 4475 | Risk Ratio (M‐H, Random, 95% CI) | 0.67 [0.40, 1.11] |
| 4 Death from all causes ‐ modified ITT analysis Show forest plot | 4 | 5253 | Risk Ratio (M‐H, Random, 95% CI) | 1.09 [0.86, 1.38] |
| 5 Incidence of oesophageal squamous cell carcinoma ‐ modified ITT analysis Show forest plot | 1 | 1630 | Risk Ratio (M‐H, Random, 95% CI) | 1.99 [0.18, 21.91] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Incidence of gastric cancer according to presence or absence of pre‐neoplastic lesions at baseline Show forest plot | 6 | 6481 | Risk Ratio (M‐H, Random, 95% CI) | 0.72 [0.45, 1.17] |
| 1.1 Patients with precancerous lesions | 4 | 3425 | Risk Ratio (M‐H, Random, 95% CI) | 0.86 [0.47, 1.59] |
| 1.2 Patients with out precancerous lesions | 2 | 1812 | Risk Ratio (M‐H, Random, 95% CI) | 0.42 [0.02, 7.69] |
| 1.3 Mixed patients with and without precancerous lesions or ulcer (can't separate) | 2 | 1244 | Risk Ratio (M‐H, Random, 95% CI) | 0.38 [0.12, 1.23] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Incidence of gastric cancer according to use of vitamins or anti‐oxidants Show forest plot | 6 | 6497 | Risk Ratio (M‐H, Random, 95% CI) | 0.67 [0.45, 1.01] |
| 1.1 Without antioxidants | 6 | 4160 | Risk Ratio (M‐H, Random, 95% CI) | 0.82 [0.46, 1.45] |
| 1.2 With antioxidants | 2 | 2337 | Risk Ratio (M‐H, Random, 95% CI) | 0.52 [0.31, 0.87] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Incidence of gastric cancer ‐ modified ITT analysis substituting the 10‐year follow‐up data from Zhou 2008 with the 5‐year follow‐up data from Leung 2004 Show forest plot | 6 | 6532 | Risk Ratio (M‐H, Random, 95% CI) | 0.69 [0.49, 0.98] |
| 2 Incidence of gastric cancer ‐ complete case analysis substituting the 10‐year follow‐up data from Zhou 2008 with the 5‐year follow‐up data from Leung 2004 Show forest plot | 6 | 5921 | Risk Ratio (M‐H, Random, 95% CI) | 0.69 [0.48, 0.98] |
| 3 Incidence of gastric cancer‐ modified ITT analysis including the two arms of celecoxib from Wong 2012 Show forest plot | 6 | 7008 | Risk Ratio (M‐H, Random, 95% CI) | 0.69 [0.48, 0.97] |
| 4 Incidence of gastric cancer ‐ modified ITT analysis including all randomised patients from Correa 2000 and You 2006 who were found subsequently to be ineligible or did not receive treatment Show forest plot | 6 | 6648 | Risk Ratio (M‐H, Random, 95% CI) | 0.67 [0.47, 0.95] |
| 5 Incidence of gastric cancer ‐ missing data imputation based on various assumptions Show forest plot | 6 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 5.1 Assuming incidence of gastric cancer for missing participants in both arms same as observed in the trial control arm | 6 | 6497 | Risk Ratio (M‐H, Random, 95% CI) | 0.66 [0.47, 0.94] |
| 5.2 Assuming incidence of gastric cancer for missing participants in treatment arm same as observed in the trial control arm, but no new gastric cancer cases in the control arm among those with missing data | 6 | 6497 | Risk Ratio (M‐H, Random, 95% CI) | 0.69 [0.48, 0.98] |

